题目内容
实验室可以用KMnO4固体和浓盐酸反应制取氯气,反应方程式如下:
2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O。
①请用“双线桥”标出电子转移的方向和数目;(2分)
②该反应中被氧化和未被氧化的HCl的物质的量之比是 _______。(1分)
2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O。
①请用“双线桥”标出电子转移的方向和数目;(2分)
②该反应中被氧化和未被氧化的HCl的物质的量之比是 _______。(1分)
① ②5:3
②5:3
 ②5:3
②5:3试题分析:根据方程式2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O可知,高锰酸钾中Mn元素的化合价从+7价降低到+2价,得到5个电子,高锰酸钾是氧化剂。氯化氢中氯元素的化合价从-1价升高到0价失去1个电子,氯化氢是还原剂。根据电子得失守恒可知,氧化剂与还原剂的物质的量之比1:5,据此可以用双线桥标出电子转移的方向和数目(见答案);根据方程式可知2mol高锰酸钾与16mol氯化氢反应,其中被氧化的氯化氢是5mol×2=10mol,则未被氧化的氯化氢是16mol-10mol=6mol,因此该反应中被氧化和未被氧化的HCl的物质的量之比是10:6=5:3。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
 组成元素相同,含有的电子数也相同
组成元素相同,含有的电子数也相同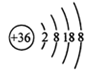

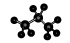
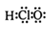
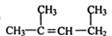 的名称为:1,3-二甲基-2-丁烯
的名称为:1,3-二甲基-2-丁烯 Na++HSO4-
Na++HSO4-