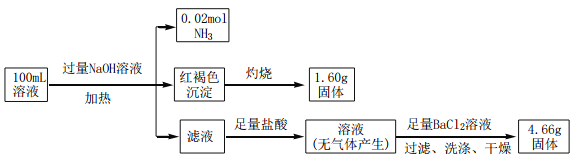
题目内容
【题目】高高纯MnCO3是制备高性能磁性材料的主要原料.实验室以MnO2为原料制备少量高纯MnCO3的操作步骤如下: 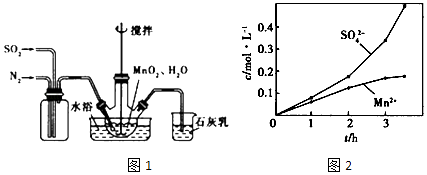
(1)制备MnSO4溶液:在烧瓶中(装置图1)加入一定量MnO2和水,搅拌,通入SO2和N2混合气体,反应3h.停止通入SO2 , 继续反应片刻,过滤
①写出反应方程式:MnO2+H2SO3=;石灰乳参与反应的化学方程式为 .
②反应过程中,为使SO2尽可能转化完全,在通人SO2和N2比例一定、不改变固液投料的条件下,可采取的合理措施有(填两种)、 .
③若实验中将N2换成空气,测得反应液中Mn2+、SO42﹣的浓度随反应时间t变化如图2.导致溶液中Mn2+、SO42﹣浓度变化产生明显差异,若其中Mn2+对O2与H2SO3反应所起的作用是 .
(2)制备高纯MnCO3固体:已知MnCO3难溶于水、乙醇,潮湿时易被空气氧化,100℃开始分解;Mn(OH)2开始沉淀的pH=7.7.
请补充由(1)制得的MnSO4溶液制备高纯MnCO3的操作步骤[实验中可选用的试剂:H2O,Ca(OH)2、NaHCO3、Na2CO3、C2H5OH].
①边搅拌边加入 , 并控制溶液pH7.7;
②;
③;
④;
⑤低于100℃干燥.
【答案】
(1)MnSO4+H2O;SO2+Ca(OH)2=CaSO3+H2O;控制适当的温度;缓慢通入混合气体;Mn2+催化氧气与亚硫酸反应生成硫酸
(2)碳酸钠;<;滤,用少量水洗涤2﹣3次;检验SO42﹣是否被洗涤干净;用少量的乙醇洗涤
【解析】解:(1)①MnO2做氧化剂把亚硫酸氧化为硫酸,自身被还原为Mn2+ , 故反应的离子方程式为:MnO2+H2SO3=MnSO4+H2O;石灰乳的作用是吸收尾气二氧化硫,碱和酸性氧化物反应得到对应的盐和水,反应为SO2+Ca(OH)2=CaSO3+H2O;所以答案是:MnSO4+H2O;SO2+Ca(OH)2=CaSO3+H2O;②为使SO2尽可能转化完全,一定要保证控制反应的温度,在通入SO2和N2比例一定、不改变固液投料的条件下,要求所通气体一定要慢;
所以答案是:控制适当的温度、缓慢通入混合气体;③氮气的化学性质稳定,空气中氧气性质活泼,在Mn2+催化作用下,易把亚硫酸氧化成硫酸,而使硫酸根浓度增大;
所以答案是:Mn2+催化氧气与亚硫酸反应生成硫酸;(2)制取的原理是碳酸根和锰离子之间反应生成碳酸锰的过程,但要考虑MnCO3难溶于水、乙醇并在潮湿时易被空气氧化,100℃开始分解以及Mn(OH)2开始沉淀时pH=7.7等因素,过程中控制溶液的PH值以及洗涤沉淀所选的溶剂要小心,所以实验步骤为:①边搅拌边加入 Na2CO3 , 并控制溶液pH<7.7;②过滤,用少量水洗涤2~3次;③检验SO42﹣是否被洗涤干净:取最后一次洗涤液于试管中,滴加BaCl2溶液,再滴加稀盐酸,若无沉淀生成,则洗涤干净;④用少量乙醇洗涤;⑤低于100℃干燥;
所以答案是:①碳酸钠;<;
②过滤,用少量水洗涤2﹣3次; ③检验SO42﹣是否被洗涤干净;④用少量的乙醇洗涤.

 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案【题目】不同温度下水的离子积常数如表所示:
t/℃ | 0 | 10 | 20 | 25 | 40 | 50 | 100 |
KW/10﹣14 | 0.114 | 0.292 | 0.681 | 1.00 | 2.92 | 5.47 | 55.0 |
①请用文字解释随温度升高水的离子积增大的原因:
②25℃条件下,pH=4的盐酸溶液中由水电离出来的H+的浓度为mol/L
③10℃时纯水的电离平衡常数为 .