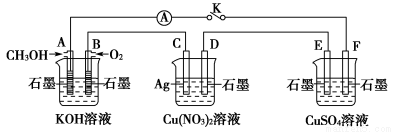
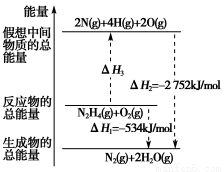
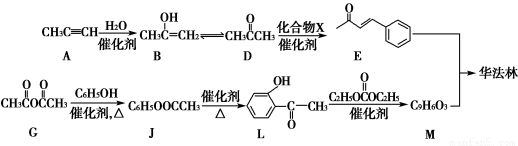
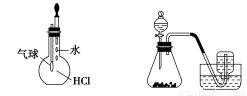
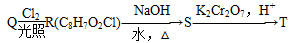题目内容
金属钛(Ti)性能优越,被称为继铁、铝之后的“第三金属”。工业上以金红石为原料制取Ti的反应为
(1)aTiO2+bCl2+cC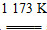 aTiCl4+cCO
aTiCl4+cCO
(2)TiCl4+2Mg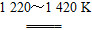 Ti+2MgCl2
Ti+2MgCl2
关于反应(1)、(2)的分析不正确的是
①TiCl4在反应(1)中是还原产物,在反应(2)中是氧化剂
②C、Mg在反应中均为还原剂,发生还原反应 ③每生成19.2 g Ti,反应(1)、(2)中共转移4.8 mol e- ④a=1,b=c=2
A.①②④ B.②③④ C.③④ D.②③
D
【解析】 反应(1)中氧化剂是Cl2,故还原产物为TiCl4,还原剂是C,故氧化产物是CO,反应(2)中钛元素由反应物TiCl4中的+4价降低为生成物Ti中的0价,故TiCl4为氧化剂,Mg为还原剂,由此可知①正确,还原剂发生氧化反应,②错误。根据氧化还原反应的配平方法可知反应(1)的化学方程式为TiO2+2Cl2+2C=TiCl4+2CO,因此a=1,b=c=2,④正确。19.2 g Ti为0.4 mol,反应(2)中生成0.4 mol Ti,转移1.6 mol电子,消耗0.4 mol TiCl4,由配平后的反应(1)可知,生成0.4 mol TiCl4,转移1.6 mol电子,故反应(1)、(2)中共转移3.2 mol电子,③错误。

练习册系列答案
 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案 期末好成绩系列答案
期末好成绩系列答案
相关题目