题目内容
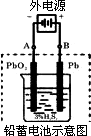
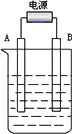
在实验室中电解500ml某0.03mol/L的NaCl溶液,通电一段时间后溶液的pH值从7增加到12时(设电解时溶液的体积变化忽略不计),阴极产生________ml气体(标况),溶液中NaCl的浓度为________mol/L.
解析:
|
解析: pH从7增加到12,生成的NaOH为:0.01×0.5-10-7×0.5≈5×10-3mol,由电子守恒关系可知如下关系:2NaOH~H2,所以V(H2)=5×10-3× c(NaCl)=(0.03×0.5-5×10-3)÷0.5=0.02mol/L. 电化学的有关计算均是根据电子守恒关系的计算或由此推导出一些相当的关系,所以引导学生推论关系式十分必要.掌握电子守恒,以不变应万变. |

 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案(19分)高锰酸钾是锰的重要化合物和常用的氧化剂。以下是实验室中模拟工业上用软锰矿制备高锰酸钾的流程图。
(1)操作Ⅰ的名称为 ;操作Ⅲ的名称为 。
(2)反应②的化学方程式为 。工业上用上述原理生产KMnO4方法产率较低,较好的制备方法是电解法。用Pt作阳极,Fe作阴极,K2MnO4为电解液,阳极的电极反应式为 。
(3)KMnO4是一种较稳定的化合物,但日光对KMnO4溶液的分解有催化作用,生成MnO2、KOH和O2。而MnO2也是该分解反应的一种催化剂,请你设计一个实验方案,验证MnO2对该分解反应具有催化性: 。
(4)KMnO4在酸性介质中的强氧化性广泛应用于分析化学中。
例如:2KMnO4+3H2SO4+5Na2SO35Na2SO4+K2SO4+2MnSO4+3H2O。某同学用KMnO4测定实验室长期存放的Na2SO3固体的纯度。现欲准确称取6.3 gNa2SO3固体样品,配成500 mL溶液。取25.00 mL上述溶液放入锥形瓶中,用0.01000 mol/L 的酸性KMnO4溶液进行滴定。滴定结果如下表所示:
| 滴定次数 | 待测溶液的体积/mL | 标准溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00 mL | 0.02 | 24.01 |
| 2 | 25.00 mL | 0.70 | 24.71 |
| 3 | 25.00 mL | 0.20 | 24.20 |
①配制500 mLNa2SO3溶液时,必须用到的实验仪器有:烧杯、玻璃棒、胶头滴管、药匙和 、 。
②判断滴定终点的依据是 。
③下列操作会导致测定结果偏高的是
A.未用标准浓度的酸性KMnO4溶液润洗滴定管
B.滴定前锥形瓶未干燥
C.滴定前滴定管尖嘴部分有气泡
D.观察读数时,滴定前仰视,滴定后俯视
④用上述实验数据,计算Na2SO3的纯度为 。
(19分)高锰酸钾是锰的重要化合物和常用的氧化剂。以下是实验室中模拟工业上用软锰矿制备高锰酸钾的流程图。
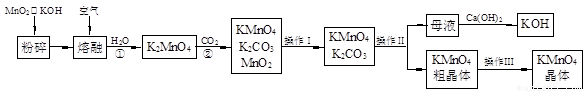
(1)操作Ⅰ的名称为 ;操作Ⅲ的名称为 。
(2)反应②的化学方程式为 。工业上用上述原理生产KMnO4方法产率较低,较好的制备方法是电解法。用Pt作阳极,Fe作阴极,K2MnO4为电解液,阳极的电极反应式为 。
(3)KMnO4是一种较稳定的化合物,但日光对KMnO4溶液的分解有催化作用,生成MnO2、KOH和O2。而 MnO2也是该分解反应的一种催化剂,请你设计一个实验方案,验证MnO2对该分解反应具有催化性: 。
(4)KMnO4在酸性介质中的强氧化性广泛应用于分析化学中。
例如:2KMnO4+3H2SO4+5Na2SO35Na2SO4+K2SO4+2MnSO4+3H2O。某同学用KMnO4测定实验室长期存放的Na2SO3固体的纯度。现欲准确称取6.3 g Na2SO3固体样品,配成500 mL溶液。取25.00 mL上述溶液放入锥形瓶中,用0.01000 mol/L 的酸性KMnO4溶液进行滴定。滴定结果如下表所示:
|
滴定次数[来源:][来源:Z&xx&k.Com] |
待测溶液的体积/mL[来源:学#科#网Z#X#X#K] |
标准溶液的体积[来源:] |
|
|
滴定前刻度/mL |
滴定后刻度/mL |
||
|
1 |
25.00 mL |
0.02 |
24.01 |
|
2 |
25.00 mL |
0.70 |
24.71 |
|
3 |
25.00 mL |
0.20 |
24.20 |
①配制500 mLNa2SO3溶液时,必须用到的实验仪器有:烧杯、玻璃棒、胶头滴管、药匙和 、 。
②判断滴定终点的依据是 。
③下列操作会导致测定结果偏高的是
A.未用标准浓度的酸性KMnO4溶液润洗滴定管
B.滴定前锥形瓶未干燥
C.滴定前滴定管尖嘴部分有气泡
D.观察读数时,滴定前仰视,滴定后俯视
④用上述实验数据,计算Na2SO3的纯度为 。