题目内容
9.分子式为C4H10O的有机物A,①A催化氧化得B;②A发生消去反应得C;③C与水加成后的产物催化氧化也得B.试写出A、B、C可能的结构简式.A:CH3CHOHCH2CH3或CH2OHCH2CH2CH3B:CH3CH2CH2CHO或
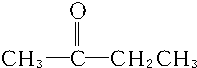 C:CH2═CH-CH2CH3或CH3CH═CH-CH3.
C:CH2═CH-CH2CH3或CH3CH═CH-CH3.
分析 根据A的分子式C4H10O可知,A是一种种饱和结构,可能是醇或醚,A催化氧化得B,A发生消去反应得C,则A为醇,且与羟基相连的碳上有氢原子,C为烯,C与水加成后的产物催化氧化也得B,C与水加成后氢原子连在氢原子多的碳原子上,则A应为CH3CHOHCH2CH3或CH2OHCH2CH2CH3,可知B为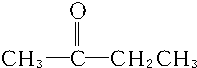 ,则C为CH2═CH-CH2CH3或CH3CH═CH-CH3,据此答题.
,则C为CH2═CH-CH2CH3或CH3CH═CH-CH3,据此答题.
解答 解:A的分子式C4H10O可知,A是一种种饱和结构,可能是醇或醚,A催化氧化得B,A发生消去反应得C,则A为醇,且与羟基相连的碳上有氢原子,C为烯,C与水加成后的产物催化氧化也得B,C与水加成后氢原子连在氢原子多的碳原子上,则A为CH3CHOHCH2CH3或CH2OHCH2CH2CH3,B为CH3CH2CH2CHO或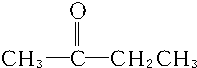 ,C为CH2═CH-CH2CH3或CH3CH═CH-CH3,
,C为CH2═CH-CH2CH3或CH3CH═CH-CH3,
故答案为:CH3CHOHCH2CH3或CH2OHCH2CH2CH3;CH3CH2CH2CHO或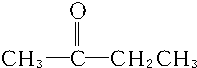 ;CH2═CH-CH2CH3或CH3CH═CH-CH3.
;CH2═CH-CH2CH3或CH3CH═CH-CH3.
点评 本题考查了有机物的推断,明确有机物的结构特点及官能团的性质是解本题关键,难度不大,注重对基础知识的考查.

练习册系列答案
相关题目
17.随着环保意识增强,清洁能源越来越受到人们关注.甲烷是一种较为理想的洁净燃料.以下是利用化学反应原理中的有关知识对甲烷转化问题的研究.
(1)已知:CH4(g)+2O2(g)═CO2(g)+2H2O(g);△H=-802.3kJ•mol-1
H2O(l)═H2O(g),△H=+44.0kJ•mol-1
则1.6g甲烷气体完全燃烧生成液态水,放出热量为89.03kJ.
(2)利用甲烷与水反应制备氢气,因原料廉价,具有推广价值.该反应可表示为CH4(g)+H2O(g)?CO(g)+3H2(g)△H=+206.1kJ•mol-1.为了探究温度、压强对上述化学反应速率的影响,某同学设计了以下三组对比实验(温度为360℃或480℃、压强为101kPa或303kPa,其余实验条件见下表).
表中t=480,p=303;设计实验2、3的目的是探究温度对化学反应速率的影响.实验1、2、3中反应的化学平衡常数的大小关系是K2>K1=K3(用K1、K2、K3表示).
(3)若800℃时,反应CH4(g)+H2O(g)?CO(g)+3H2(g)△H=+206.1kJ•mol-1的平衡常数(K)=1.0,某时刻测得该温度下密闭容器中各物质的物质的量浓度如下表:
则此时正、逆反应速率的关系是C(填标号)
A.v(正)<v(逆) B.v(正)=v(逆) C.v(正)>v(逆) D.无法判断.
(1)已知:CH4(g)+2O2(g)═CO2(g)+2H2O(g);△H=-802.3kJ•mol-1
H2O(l)═H2O(g),△H=+44.0kJ•mol-1
则1.6g甲烷气体完全燃烧生成液态水,放出热量为89.03kJ.
(2)利用甲烷与水反应制备氢气,因原料廉价,具有推广价值.该反应可表示为CH4(g)+H2O(g)?CO(g)+3H2(g)△H=+206.1kJ•mol-1.为了探究温度、压强对上述化学反应速率的影响,某同学设计了以下三组对比实验(温度为360℃或480℃、压强为101kPa或303kPa,其余实验条件见下表).
| 实验序号 | 温度/℃ | 压强/kPa | CH4初始浓度/mol•L-1 | H2O初始浓度/mol•L-1 |
| 1 | 360 | p | 2.00 | 6.80 |
| 2 | t | 101 | 2.00 | 6.80 |
| 3 | 360 | 101 | 2.00 | 6.80 |
(3)若800℃时,反应CH4(g)+H2O(g)?CO(g)+3H2(g)△H=+206.1kJ•mol-1的平衡常数(K)=1.0,某时刻测得该温度下密闭容器中各物质的物质的量浓度如下表:
| CH4 | H2O | CO | H2 |
| 3.0mol•L-1 | 8.5mol•L-1 | 2.0mol•L-1 | 2.0mol•L-1 |
A.v(正)<v(逆) B.v(正)=v(逆) C.v(正)>v(逆) D.无法判断.
4.T1温度时,向密闭容器中通入N2O5,发生以下反应:2N2O5(g)?4NO3(g)+O2(g)△H>0,部分实验数据简下表下列说法中不正确的是( )
| 时间/s | 0 | 50 | 100 | 150 |
| c(N2O5)/mol.L-1 | 2.50 | 1.76 | 1.25 | 1.25 |
| A. | T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若T1>T2,则K1<K2 | |
| B. | 50s内N2O5分解速率为1.48×10-2mol.L-1.s-1 | |
| C. | T1温度下的平衡常数为K1=15.625,平衡时N2O5的转化率为50% | |
| D. | 达到平衡后其他 条件不变,将容器的体积压缩到原来的$\frac{1}{2}$,则c(N2O5)>2.50mol.L-1 |
14.在10L恒容密闭容器中发生反应:X(g)+Y(g)?2Z(g)△H<0.T℃时,各物质的物质的量与时间关系如下表:下列说法正确的是( )
| 时间/min | n(X)/mol | n(Y)/mol | n(Z)/mol |
| 0 | 0.20 | 0.60 | 0 |
| 10 | a1 | a2 | 0.25 |
| 13 | b1 | 0.45 | b2 |
| 15 | d1 | d2 | 0.30 |
| A. | 前10 min内的平均反应速率v(Y)=2.5×10-3 mol/(L•min) | |
| B. | 保持其它条件不变,升高温度,反应达平衡时c(X)<5.0×10-3 mol/L | |
| C. | 若起始时只充入0.60 mol Z(g),反应达平衡时Z(g)的转化率为50% | |
| D. | 若起始时充入0.60 mol X(g)、0.10 mol Y(g)和0.50 mol Z(g),达到平衡前v(正)>v(逆) |
18.900℃时,向2.0L恒容密闭容器中充入0.40mol乙苯,发生反应: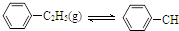 =CH2(g)+H2(g)△H=a kJ•mol-1下列说法正确的是( )
=CH2(g)+H2(g)△H=a kJ•mol-1下列说法正确的是( )
经一段时间后达到平衡.反应过程中测定的部分数据见下表:
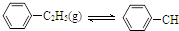 =CH2(g)+H2(g)△H=a kJ•mol-1下列说法正确的是( )
=CH2(g)+H2(g)△H=a kJ•mol-1下列说法正确的是( )经一段时间后达到平衡.反应过程中测定的部分数据见下表:
| 时间/min | 0 | 10 | 20 | 30 | 40 |
| n(乙苯)/mol | 0.40 | 0.30 | 0.24 | n2 | n3 |
| n(苯乙烯)/mol | 0.00 | 0.10 | n1 | 0.20 | 0.20 |
| A. | 保持其他条件不变,向容器中充入不参与反应的水蒸气作为稀释剂,则乙苯的转化率大于50% | |
| B. | 反应在前20 min的平均速率为v(H2)=0.004mol•L-1•min-1 | |
| C. | 保持其他条件不变,升高温度,平衡时,c(乙苯)=0.08mol•L-1,则a<0 | |
| D. | 相同温度下,起始时向容器中充入0.10mol乙苯、0.10mol苯乙烯和0.30molH2,达到平衡前v(正)>v(逆) |
19.许多物质都有俗称.以下物质的俗称与化学式不相符的是( )
| A. | 干冰CO2 | B. | 生石灰CaO | C. | 熟石灰Ca(OH)2 | D. | 纯碱NaOH |
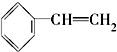 ④
④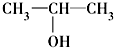 ⑤
⑤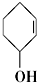 ⑥
⑥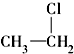 ⑦
⑦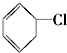 ⑧
⑧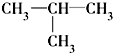 ⑨CH3-CH=CH2 (10)
⑨CH3-CH=CH2 (10)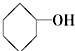 (11)
(11)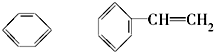 ⑫CH3Cl
⑫CH3Cl
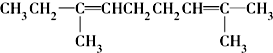 .
. 实验室制乙烯,常因温度过高而使乙醇和浓H2SO4反应生成少量的二氧化硫.有人设计下列实验以确证上述混合气体中含有乙烯和二氧化硫.
实验室制乙烯,常因温度过高而使乙醇和浓H2SO4反应生成少量的二氧化硫.有人设计下列实验以确证上述混合气体中含有乙烯和二氧化硫. $\stackrel{AlCl_{3}}{→}$
$\stackrel{AlCl_{3}}{→}$ +HCl,下列是由苯制取有机物“茚”的反应过程:
+HCl,下列是由苯制取有机物“茚”的反应过程: $\stackrel{SOCl_{2}}{→}$
$\stackrel{SOCl_{2}}{→}$ $→_{②}^{博.克反应}$X$→_{③}^{H_{2}/催化剂}$
$→_{②}^{博.克反应}$X$→_{③}^{H_{2}/催化剂}$ $→_{④}^{浓H_{2}SO_{4}/△}$茚
$→_{④}^{浓H_{2}SO_{4}/△}$茚 、茚
、茚 ;
; 互为同分异构体,有一苯环且苯环上有互为对位的2个取代基,并能与NaOH反应的有机物的结构简式(写出三种)
互为同分异构体,有一苯环且苯环上有互为对位的2个取代基,并能与NaOH反应的有机物的结构简式(写出三种) .
. 有下列性质AD
有下列性质AD 的合成路线流程图(其他无机试剂任选).
的合成路线流程图(其他无机试剂任选).