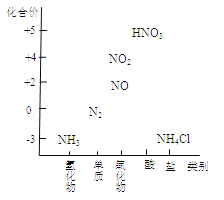
题目内容
【题目】在氧化还原反应中,氧化剂__电子,发生的反应是__反应;还原剂__电子,发生的反应是__反应。铁与氯气反应的方程式为__,生成物中铁是__价,铁与盐酸的反应化学方程式为___,生成物中铁是___价,这一事实证明,氯气的氧化性比盐酸的氧化性__(填“强”或“弱”)。
【答案】得到 还原 失去 氧化 2Fe+3Cl2![]() 2FeCl3 +3 Fe+2HCl═FeCl2+H2↑ +2 强
2FeCl3 +3 Fe+2HCl═FeCl2+H2↑ +2 强
【解析】
氧化还原反应中,氧化剂得到电子被还原,发生还原反应,而还原剂失去电子被氧化,发生氧化反应;Fe与氯气反应生成氯化铁,Fe与盐酸反应生成氯化亚铁,可知氯气得电子能力强,以此来解答。
氧化还原反应中,氧化剂得到电子被还原,发生还原反应,而还原剂失去电子被氧化,发生氧化反应;Fe与氯气反应生成氯化铁,该反应为2Fe+3Cl2![]() 2FeCl3,生成物中Fe元素的化合价为+3价,Fe与盐酸反应生成氯化亚铁,该反应为Fe+2HCl═FeCl2+H2↑,生成物中Fe元素的化合价为+2价,由两个反应可知氯气得电子能力比HCl强,即氯气的氧化性比盐酸的氧化性强,
2FeCl3,生成物中Fe元素的化合价为+3价,Fe与盐酸反应生成氯化亚铁,该反应为Fe+2HCl═FeCl2+H2↑,生成物中Fe元素的化合价为+2价,由两个反应可知氯气得电子能力比HCl强,即氯气的氧化性比盐酸的氧化性强,
故答案为:得到;还原;失去;氧化;2Fe+3Cl2![]() 2FeCl3;+3;Fe+2HCl═FeCl2+H2↑;+2;强。
2FeCl3;+3;Fe+2HCl═FeCl2+H2↑;+2;强。

【题目】下列实验所得结论正确的是
① | ② | ③ | ④ |
|
|
|
|
充分振荡试管,下层溶液红色褪去 | 溶液变红 | 溶液变红 | 充分振荡右侧小试管, 下层溶液红色褪去 |
A.①中溶液红色褪去的原因是:CH3COOC2H5+NaOH![]() CH3COONa+C2H5OH
CH3COONa+C2H5OH
B.②中溶液变红的原因是:CH3COO-+H2O![]() CH3COOH+H+
CH3COOH+H+
C.由实验①、②、③推测,①中红色褪去的原因是乙酸乙酯萃取了酚酞
D.④中红色褪去证明右侧小试管中收集到的乙酸乙酯中混有乙酸
【题目】硼氢化钠(NaBH4)通常为白色粉末,容易吸水潮解,可溶于异丙胺(熔点:-101℃,沸点:33℃),在有机合成中被称为“万能还原剂”。制备硼氢化钠的流程如图:
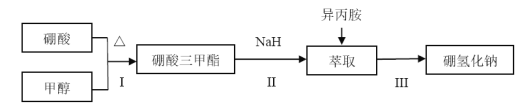
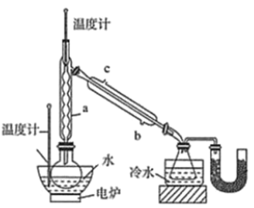
硼酸三甲酯的制备:将硼酸(H3BO3)和适量甲醇加入圆底烧瓶中,然后缓慢地加入浓硫酸,振荡,在烧瓶上加装分馏柱a,用电炉经水浴锅加热,回流2小时,收集硼酸三甲酯与甲醇共沸液。装置如图所示(夹持装置略去,下同)。
硼酸三甲酯B(OCH3)3 | 甲醇 | 甲醇钠 | |
溶解性 | 与乙醇、甲醇混溶,能水解 | 与水混溶 | 溶于甲醇,不溶于异丙胺 |
沸点/℃ | 68 | 64 | 450 |
硼酸三甲酯与甲醇混合物的共沸点为54℃ | |||
(1)直形冷凝管冷却水应从________(填“b”或“c”)接口进入。
(2)浓硫酸的作用是_______。
(3)本实验采用水浴加热,优点是________;U型管中试剂的作用是__________。
(4)在240℃条件下进行,硼酸三甲酯与氢化钠反应制取NaBH4,同时生成CH3ONa,写出该反应的化学方程式______。
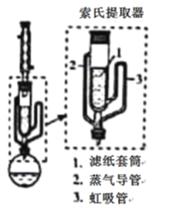
(5)萃取时可采用索氏提取法,其装置如图所示。实验时烧瓶中溶剂受热蒸发,蒸汽沿导管2上升至球形冷凝管,冷凝后滴入滤纸套筒1中,进行萃取。萃取液液面达到虹吸管3顶端时,经虹吸管3返回烧瓶,从而实现连续萃取。当萃取完全后,硼氢化钠在_______(填“圆底烧瓶”或“索氏提取器”)中。
(6)分离NaBH4并回收溶剂,采用的方法是_______。
(7)“有效氢含量”可用来衡量含氢还原剂的还原能力,定义是:每克含氢还原剂的还原能力相当于多少克H2的还原能力。NaBH4的有效氢含量为_____________(保留两位小数)。