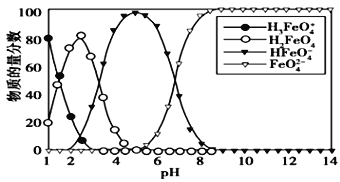
题目内容
【题目】用NA表示阿伏加德罗常数的值,下列说法中正确的是
A. 2.4 g金属镁与足量盐酸反应,转移电子的数目为0.1 NA
B. 1L 1 mol·L-1的CaCl2溶液中含Cl-的数目为NA
C. 在25℃、1.01×105Pa的条件下,2.24 L H2中含有的分子数小于0.1 NA
D. 22 g CO2与标准状况下11.2 L H2O含有相同的分子数
【答案】C
【解析】A. 2.4 g金属镁与足量盐酸反应,转移电子的数目为0.2NA,故A错误;B. CaCl2![]() Ca2++2Cl-,1L 1 mol·L-1的CaCl2溶液中含Cl-的数目为2NA,故B错误;C. 在25℃、1.01×105Pa的条件下,气体摩尔体积大于22.4L/mol,所以2.24 L H2的物质的量小于0.1mol,含有的分子数小于0.1 NA,故C正确;D. 22 g CO2的物质的量是0.5mol,标准状况下水呈非气态,11.2 L H2O的物质的量大于0.5mol,所以22 g CO2与标准状况下11.2 L H2O含有的分子数不同,故D错误。故选C。
Ca2++2Cl-,1L 1 mol·L-1的CaCl2溶液中含Cl-的数目为2NA,故B错误;C. 在25℃、1.01×105Pa的条件下,气体摩尔体积大于22.4L/mol,所以2.24 L H2的物质的量小于0.1mol,含有的分子数小于0.1 NA,故C正确;D. 22 g CO2的物质的量是0.5mol,标准状况下水呈非气态,11.2 L H2O的物质的量大于0.5mol,所以22 g CO2与标准状况下11.2 L H2O含有的分子数不同,故D错误。故选C。

 春雨教育同步作文系列答案
春雨教育同步作文系列答案【题目】为探究Cl2、Br2、Fe3+的氧化性强弱,某化学兴趣小组设计了如下实验:

(1)①A是氯气发生装置,其反应的离子方程式是__________________________________。
②B装置的作用是_________________________,C装置的作用是_______________________,整套实验装置存在一处明显不足,请指出_______________________________________________________。
(2)用改正后的装置进行实验。实验过程如下:
实验操作 | 实验现象 |
打开活塞a,向圆底烧瓶中滴入少量浓盐酸,然后关闭活塞a,点燃酒精灯 | D装置中:溶液变红 E装置中: 振荡后水层溶液变黄,CCl4无明显变化 |
继续滴入浓盐酸,D、E中均发生了新的变化:
D装置中:红色慢慢褪去。E装置中:CC14层先由无色变为橙色,后颜色逐渐变成红色。
为探究上述实验现象的本质,小组同学查得资料如下:
I:(SCN)2 性质与卤素相似,氧化性Cl2大于(SCN)2,且SCN-的电子式为![]()
II:AgClO、AgBrO 均可溶于水
Ⅲ:Cl2 和Br2反应生成BrCl、BrCl呈红色,沸点约为5℃,与水发生水解反应
①小组同学认为D装置中红色褪去的原因是由于SCN-被Cl2氧化,但一定不是碳元素被氧化,他的理由是__________________________________________。
②经过实验证实了小组同学推测的合理性,请用平衡移动原理解释Cl2过量时D中溶液红色褪去的原因__________________________________________。
③欲探究E 中继续滴加浓盐酸后颜色变化的原因,设计实验如下:用分液漏斗分离出E的下层溶液,蒸馏、收集红色物质,取少量,加入AgNO3溶液,结果观察到仅有白色沉淀产生。请结合化学用语解释仅产生白色沉淀的原因_________________________________________________。