题目内容
下列离子方程式正确的是( )
| A、HCO3-水解的离子方程式:HCO3-+H2O?CO32-+H3O+ | ||||
B、用铜为电极电解饱和食盐水:2Cl-+2H2O
| ||||
| C、用白醋除铁锈:Fe2O3+6H+═3H2O+2Fe3+ | ||||
| D、向FeCl3溶液中加入Mg(OH)2:3Mg(OH)2+2Fe3+═2Fe(OH)3+3Mg2+ |
考点:离子方程式的书写
专题:离子反应专题
分析:A.碳酸氢根离子水解生成碳酸和氢氧根离子;
B.用铜作电极电解饱和食盐水时,阳极上铜失电子、阴极上氢离子得电子;
C.弱电解质写化学式;
D.氢氧化镁能转化为氢氧化铁沉淀.
B.用铜作电极电解饱和食盐水时,阳极上铜失电子、阴极上氢离子得电子;
C.弱电解质写化学式;
D.氢氧化镁能转化为氢氧化铁沉淀.
解答:
解:A.碳酸氢根离子水解生成碳酸和氢氧根离子,其水解方程式为HCO3-+H2O?H2CO3+HO-,故A错误;
B.用铜作电极电解饱和食盐水时,阳极上铜失电子、阴极上氢离子得电子,离子方程式为Cu+2H2O
Cu(OH)2↓+H2↑,故B错误;
C.弱电解质写化学式,离子方程式为Fe2O3+6CH3COOH═3H2O+2Fe3++6CH3COO-,故C错误;
D.氢氧化镁能转化为氢氧化铁沉淀,离子方程式为3Mg(OH)2+2Fe3+═2Fe(OH)3+3Mg2+,故D正确;
故选D.
B.用铜作电极电解饱和食盐水时,阳极上铜失电子、阴极上氢离子得电子,离子方程式为Cu+2H2O
| ||
C.弱电解质写化学式,离子方程式为Fe2O3+6CH3COOH═3H2O+2Fe3++6CH3COO-,故C错误;
D.氢氧化镁能转化为氢氧化铁沉淀,离子方程式为3Mg(OH)2+2Fe3+═2Fe(OH)3+3Mg2+,故D正确;
故选D.
点评:本题考查了离子方程式的书写,明确物质之间的反应及离子方程式书写规则是解本题关键,知道酸式酸根离子电离方程式和水解方程式的区别,注意B中活泼金属作阳极,为易错点.

练习册系列答案
相关题目
下列说法正确的是( )
| A、钢铁因含杂质而容易发生电化学腐蚀,所以合金都不耐腐蚀 |
| B、原电池反应是导致金属腐蚀的主要原因,故不能用原电池原理来减缓金属的腐蚀 |
| C、钢铁电化学腐蚀的两种类型主要区别在于水膜的酸性不同,引起的正极反应不同 |
| D、无论哪种类型的腐蚀,其实质都是金属被氧化 |
下列叙述不正确的是( )
| A、NH3易液化,液氨常用作制冷剂 |
| B、与铜反应时,浓硝酸铵被还原成NO2而稀HNO3被还原成NO,所以HNO3氧化性强于浓HNO3 |
| C、铵盐受热易分解,因此贮存液态氨肥时要密封保存,并放在阴凉通风处 |
| D、氨水逐滴滴加到硝酸银溶液中,先出现沉淀,后沉淀溶解 |
下列说法正确的是( )
| A、强电解质一定是离子化合物 |
| B、强酸、强碱及大部分盐类是强电解质 |
| C、强电解质的饱和溶液一定是浓溶液 |
| D、强电解质在水中一定能全部溶解 |
下列化合物中阳离子半径与阴离子半径比值最大的是( )
| A、NaF |
| B、LiI |
| C、MgI2 |
| D、KF |
近年来流行喝果醋,苹果醋是一种由苹果发酵而成的具有解毒、降脂、减肥和止泻等明显药效的健康食品.苹果酸( )是这种饮料的主要酸性物质.下列有关苹果酸性质的说法中,不正确的是( )
)是这种饮料的主要酸性物质.下列有关苹果酸性质的说法中,不正确的是( )
 )是这种饮料的主要酸性物质.下列有关苹果酸性质的说法中,不正确的是( )
)是这种饮料的主要酸性物质.下列有关苹果酸性质的说法中,不正确的是( )| A、可以与NaHCO3溶液反应产生CO2 |
| B、可以与乙醇发生酯化反应 |
| C、可以发生银镜反应 |
D、苹果酸与 互为同分异构体 互为同分异构体 |
 (Ⅰ)已知:H+(aq)+OH-(aq)═H2O(l)△H1=-57.3kJ/mol
(Ⅰ)已知:H+(aq)+OH-(aq)═H2O(l)△H1=-57.3kJ/mol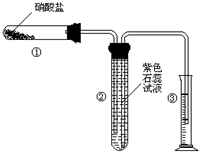 某校化学兴趣小组的同学对硝酸盐的受热分解进行探究.他们设计了如下装置分别加热了Ca(NO3)2、Cu(NO3)2、AgNO3三种固体.(加热及夹持装置未画出)
某校化学兴趣小组的同学对硝酸盐的受热分解进行探究.他们设计了如下装置分别加热了Ca(NO3)2、Cu(NO3)2、AgNO3三种固体.(加热及夹持装置未画出)