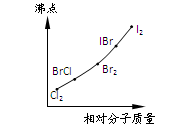
题目内容
主族元素X、Y、Z的常见离子为aX+、bY2—、cZ—,半径大小关系是X+<Z—<Y2—下列说法不正确的是
| A.b一定小于c | B.单质的氧化性Z > Y |
| C.Y2—的还原性大于Z— | D.X、Y可处于同周期或X在Y的下周期 |
A
若Y和Z属于同一周期,则核电荷数越小,离子半径越大,即b小于c。但如果Y位于Z的下一周期,则同样满足半径大小关系是Z—<Y2—,此时b大于c,所以选项A是错误的。根据离子所带的电荷数可知X、Y、Z分别属于第IA、ⅥA、ⅦA,因为Y一定不能位于Z的上一周期,所以Z单质的氧化性一定强于Y的,则相应离子的还原性就一定是Y2—的大于Z—的。若X和Y处于同一周期,则X+比Y2—少一个电子层,因此满足半径大小顺序是X+< Y2—的。若X在Y的下一周期,则X+和Y2—具有相同的电子层结构,但X的原子序数大于Y 的,所以仍然能满足离子半径大小顺序是X+< Y2—的,因此答案是A。

练习册系列答案
 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案
相关题目