题目内容
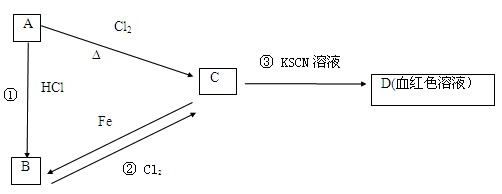
把铁粉放入氯化铜和氯化铁的混合溶液中,充分反应后,铁粉全部溶解。由此可判断下列说法正确的是
| A.若无铜析出,溶液中有Cu2+、Fe2+和Fe3+离子 |
| B.若无铜析出,溶液中有Cu2+和Fe2+离子,也可能有Fe3+离子 |
| C.若有铜析出,溶液中有Fe2+离子,没有Cu2+和Fe3+离子 |
| D.若有铜析出,溶液中有Fe2+离子,可能有Cu2+离子,也可能有Fe3+离子 |
B
铁可依次与Fe3+、Cu2+发生离子反应:①Fe+2Fe3+=3Fe2+② Fe+Cu2+=Cu+Fe2+
若无铜析出,说明反应①可能全部进行或部分进行,反应②没有发生,即A不正确,B正确
若有铜析出,则反应①已全部进行,反应②可能部分进行,也可能恰好完全反应,溶液中有Fe2+离子,可能有Cu2+离子,但绝对不可能有Fe3+离子,排除CD
答案为B
若无铜析出,说明反应①可能全部进行或部分进行,反应②没有发生,即A不正确,B正确
若有铜析出,则反应①已全部进行,反应②可能部分进行,也可能恰好完全反应,溶液中有Fe2+离子,可能有Cu2+离子,但绝对不可能有Fe3+离子,排除CD
答案为B

练习册系列答案
相关题目
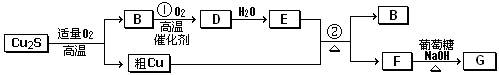
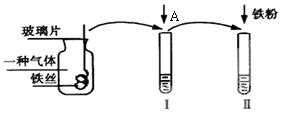
 中使用到的玻璃仪器除烧杯和漏斗外,还有________________________
中使用到的玻璃仪器除烧杯和漏斗外,还有________________________ 。
。
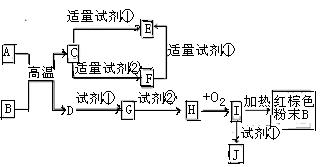
 。
。
 时间置于空气中,表面“发黄”,请用化学方程式表示原因 。
时间置于空气中,表面“发黄”,请用化学方程式表示原因 。 试计算该物质沉淀完全所需要的pH= (要求保留2位有效数字)(已知溶液中离子浓度小于10-5mol/L时,该离子可看做沉淀完全,lg2=0.3)
试计算该物质沉淀完全所需要的pH= (要求保留2位有效数字)(已知溶液中离子浓度小于10-5mol/L时,该离子可看做沉淀完全,lg2=0.3)