题目内容
11.已知:①
②
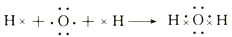
下列说法不正确的是( )
| A. | ①和②的变化过程中都有电子的得失或偏移 | |
| B. | ①和②所得的化合物中各原子均达到8电子稳定结构 | |
| C. | Na2O中含有离子键,H2O中含有极性共价键 | |
| D. | ①和②过程中原子的总能量高于相应的化合物的总能量 |
分析 氧化钠是由2个钠原子与一个氧原子得失电子形成钠离子和氧离子,通过离子键结和而成;
水分子是2个氢原子与一个氧原子通过共用电子对结合而成,据此解答.
解答 解:A.氧化钠是由2个钠原子与一个氧原子得失电子形成钠离子和氧离子,存在电子得失;水分子是2个氢原子与一个氧原子通过共用电子对结合而成,存在电子偏移,故A正确;
B.氧化钠中钠离子与氧离子都是8电子稳定结构,水分子中氢原子为2电子稳定结构,故B错误;
C.氧化钠是由2个钠离子与氧离子通过离子键结合而成,水分子是2个氢原子与一个氧原子通过共用电子对形成极性共价键结合而成,故C正确;
D.①和②过程都是放热反应,反应物总能量高于生成物总能量,故D正确;
故选:B.
点评 本题考查了化学键的类型及表示方法,熟悉离子键与共价键概念是解题关键,注意二者区别,题目难度不大.

练习册系列答案
 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案
相关题目
1.现有下列四个转化,其中不可能通过一步反应实现的是( )
| A. | SiO2→Na2SiO3 | B. | CuO→Cu (OH)2 | C. | SO2→H2SO3 | D. | CaO→Ca(OH)2 |
6.已知氨的催化氧化法制取硝酸的第一步反应:4NH3+5O2═4NO+6H2O(g),当反应中有m个电子转移时,下列说法正确的是(设NA为阿伏加德罗常数)( )
| A. | 生成水蒸气体积为6.72m/NA L | B. | 参加反应的氨气为m/5 mol | ||
| C. | 生成NO的质量为6mNA g | D. | 发生还原反应的原子数为m/2 个 |
3.下表是元素周期表的一部分,针对表中所列标号为①~⑩的元素回答下列问题.
(1)非金属性最强的元素是F(填元素符号),形成化合物种类最多的元素是C(填元素符号).
(2)第三周期元素除⑩外原子半径最小的是Cl(填元素符号),这些元素的最高价氧化物对应水化物中碱性最强的是NaOH(填化学式),具有两性的是Al(OH)3(填化学式).
(3)⑤⑥⑦三元素的金属性强弱顺序为Na>Mg>Al(填元素符号),判断的实验依据是单质与水或酸反应的剧烈程度(写出一种).
(4)元素⑨的原子结构示意图为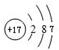 ;元素③的最低价氢化物的电子式为
;元素③的最低价氢化物的电子式为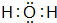 .
.
| 周期 | IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ① | ② | ③ | ④ | ||||
| 三 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
(2)第三周期元素除⑩外原子半径最小的是Cl(填元素符号),这些元素的最高价氧化物对应水化物中碱性最强的是NaOH(填化学式),具有两性的是Al(OH)3(填化学式).
(3)⑤⑥⑦三元素的金属性强弱顺序为Na>Mg>Al(填元素符号),判断的实验依据是单质与水或酸反应的剧烈程度(写出一种).
(4)元素⑨的原子结构示意图为
 ;元素③的最低价氢化物的电子式为
;元素③的最低价氢化物的电子式为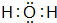 .
.
20.下列物质的水溶液呈碱性的是( )
| A. | FeCl3 | B. | KSCN | C. | CH3COOH | D. | NH4Al(SO4)2 |
1.氯水中具有杀菌消毒、漂白作用的微粒是( )
| A. | Cl2 | B. | H+ | C. | Cl- | D. | HClO |
 海水不仅是宝贵的水资源,而且蕴藏着丰富的化学资源.世界上已知的100多种元素中,80%可以在海水中找到.用化学知识回答下列问题.
海水不仅是宝贵的水资源,而且蕴藏着丰富的化学资源.世界上已知的100多种元素中,80%可以在海水中找到.用化学知识回答下列问题.