题目内容
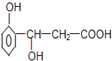
【题目】乙醇结构式如图所示,“箭头”表示乙醇发生化学反应时分子中可能断键的位置,下列叙述中不正确的是( )
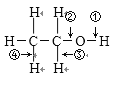
A. 与钠反应时断裂①键B. 发生消去反应时断裂②④键
C. 与乙酸发生酯化反应时断裂②键D. 发生催化氧化反应时断裂①③键
【答案】C
【解析】
A、根据乙醇与与金属钠反应生成乙醇钠和氢气,断开的羟基上的氢氧键;
B、乙醇和浓H2SO4共热至170℃时发生消去反应,断裂碳氧键、与羟基所连的碳的相邻的碳上的碳氢键;
C、乙醇与羧酸发生酯化反应时,醇脱氢、羧酸脱羟基;
D、乙醇在铜催化下与O2反应生成乙醛和水,断开的是羟基上的氢氧键和与羟基所连的碳的氢。
A项、乙醇与与金属钠反应生成乙醇钠和氢气,反应的化学方程式为2CH3CH2OH+2Na→2CH3CH2ONa+H2↑,由方程式可知乙醇断键的位置为①,故A正确;
B项、乙醇和浓H2SO4共热至170℃时,发生消去反应生成乙烯和水,反应的化学方程式为CH3CH2OH![]() CH2═CH2↑+H2O,由方程式可知乙醇断键的位置为②④,故B正确;
CH2═CH2↑+H2O,由方程式可知乙醇断键的位置为②④,故B正确;
C项、在浓硫酸作用下,乙醇和CH3COOH共热发生酯化反应生成乙酸乙酯和水,可以用18O标记乙醇,研究反应机理,反应的化学方程式为CH3COOH+CH3CH218OH![]() CH3CO18OCH2CH3+H2O,由方程式可知乙醇断键的位置为①,故C错误;
CH3CO18OCH2CH3+H2O,由方程式可知乙醇断键的位置为①,故C错误;
D项、在Cu或Ag做催化剂时,乙醇与O2共热反应生成乙醛和水,反应的化学方程式为2CH3CH2OH+O2![]() 2CH3CHO+2H2O,由方程式可知乙醇断键的位置为①和③,故D正确。
2CH3CHO+2H2O,由方程式可知乙醇断键的位置为①和③,故D正确。
故选C。

 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案【题目】欲测定某NaOH溶液的物质的量浓度,可用0.1000mol/L的HCl标准溶液进行中和滴定(用甲基橙作指示剂)。 请回答下列问题:
(1)滴定前,用移液管量取待测NaOH溶液于 _____中( 填仪器名称),并加入2~3滴指示剂;
(2)盛装标准盐酸的仪器名称为 _____ ;
(3)如何判断滴定终点(需写出颜色变化) __________ ;
某学生做了三组平行实验,数据记录如下:
(4)选取下述合理数据,算出待测NaOH溶液的物质的量浓度为 ___________;(保留四位有效数字)
实验序号 | 待测NaOH溶液的体积/ mL | 0.1000mol.L-1HCl溶液的体积/mL | |
滴定前刻度 | 滴定后刻度 | ||
1 | 25.00 | 0.00 | 26.29 |
2 | 25.00 | 1.00 | 31.00 |
3 | 25.00 | 1.00 | 27.31 |
(5)下列哪些操作会使测定结果偏低____________。
a.反应容器用蒸馏水洗净后,未用待测液润洗
b.滴定前,平视读数;滴定后,仰视读数
c.滴定前,尖嘴无气泡;滴定后,尖嘴出现气泡