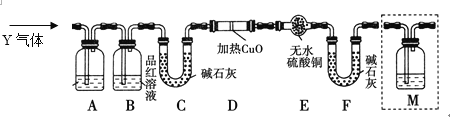
题目内容
【题目】下表是元素周期表的一部分,表中所列的字母分别代表一种化学元素。试回答下列问题:
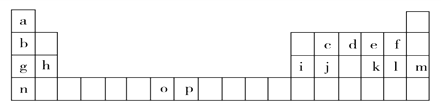
(1)基态o原子的外围电子排布图______________;基态p3+的最外层电子排布式_________;n的原子结构示意图__________。基态j原子的核外电子填充时最高能级符号为_______。
在以上元素中,没有未成对电子的元素有______种。
(2)原子序数为52的元素x在元素周期表中与以上______________元素在同一族(填写以上表中字母对应的元素符号)。
(3)上表中o、p两个字母表示的元素的第三电离能分别为I3(o)和I3(p),则I3(o)__I3(p)(填“>”或“<”)。理由是_____________________________。
(4)将以上周期表中g、h、i、j四种元素的电负性由大到小排序____________________(用元素符号表示),第一电离能由大到小排序______________(用元素符号表示)。
【答案】 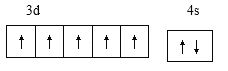 3s23p63d5
3s23p63d5  3p 2 O或S
3p 2 O或S ![]() Mn2+的3d轨道电子排布为半充满状态,比较稳定 Si> Al > Mg >Na Si>Mg>Al>Na
Mn2+的3d轨道电子排布为半充满状态,比较稳定 Si> Al > Mg >Na Si>Mg>Al>Na
【解析】根据元素周期表知,a-p各元素分别是H、Li、C、N、O、F、Na、Mg、Al、Si、S、Cl、Ar、K、Mn 、Fe。
(1)基态o原子为锰,核电荷数为25,,[Ar]3d54s2,外围电子排布图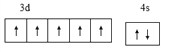 ;基态p3+ 为Fe3+,最外层电子排布式3s23p63d5 ;n原子为钾,核电荷数19,原子结构示意图
;基态p3+ 为Fe3+,最外层电子排布式3s23p63d5 ;n原子为钾,核电荷数19,原子结构示意图 ;j原子为硅,电子排布为1s22s22p63s23p2,核外电子填充时最高能级符号为3p;在以上元素中,没有未成对电子的元素有Mg、Ar两种元素,共计2种;正确答案:
;j原子为硅,电子排布为1s22s22p63s23p2,核外电子填充时最高能级符号为3p;在以上元素中,没有未成对电子的元素有Mg、Ar两种元素,共计2种;正确答案: 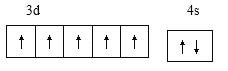 ;3s23p63d5 ;
;3s23p63d5 ;  ; 3p;2。
; 3p;2。
(2)稀有气体氙,原子序数为54,位于0族,依次前推,53号元素为碘,52号元素锑,位于VIA族,与O或S同族,正确答案:O或S。
(3)o、p分别表示锰和铁元素,由于Mn2+的3d轨道电子排布为半充满状态,比较稳定,所以第三电离能分别为I3(o) ![]() I3(p);正确答案:
I3(p);正确答案:![]() ;Mn2+的3d轨道电子排布为半充满状态,比较稳定。
;Mn2+的3d轨道电子排布为半充满状态,比较稳定。
(4)g、h、i、j四种元素分别为钠、镁、铝、硅,同一周期从左到右电负性增大,因此电负性由大到小排序:Si> Al > Mg >Na;同一周期第一电离能从左到右增大,但是IIA、 VA电离能大于邻近元素的电离能,因此第一电离能由大到小排序Si>Mg>Al>Na;正确答案:Si> Al > Mg >Na;Si>Mg>Al>Na。

【题目】下列关于物质分类的正确组合是( )
分类组合 | 碱 | 酸 | 盐 | 碱性氧化物 | 酸性氧化物 |
A | Na2SO3 | H2SO4 | NaHCO3 | SO2 | CO2 |
B | NaOH | HCl | NaCl | Na2O | NO |
C | NaOH | CH3COOH | CaF2 | CO2 | SO2 |
D | KOH | HNO3 | CaCO3 | CaO | SO2 |
A.AB.BC.CD.D