题目内容
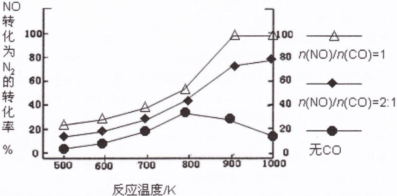
将1 mol CO和2 mol H2充入一容积为1L的密闭容器中,分别在250°C、T°C下发生反应:CO(g)+2H2(g)=CH3OH(g),ΔH="a" kJ/mol,如图。下列分析中正确的是
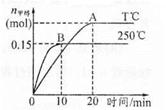
A.250°C时,0?10minH2反应速率为 0.015 mol,/(L.min)
B.平衡时CO的转化率:T℃时小于250℃时
C.其他条件不变,若减小容积体积,CO体积分数增大
D.a<0,平衡常数K:T0C时大于2500C

A.250°C时,0?10minH2反应速率为 0.015 mol,/(L.min)
B.平衡时CO的转化率:T℃时小于250℃时
C.其他条件不变,若减小容积体积,CO体积分数增大
D.a<0,平衡常数K:T0C时大于2500C
D
试题分析: A、250°C时,0?10min CH3OH反应速率为0.015 mol/(L·min),所以氢气反应速率为0.03mol/(L·min),错误;B、由图像可知,250℃时反应速率快,但平衡时甲醇物质的量小,说明正反应是放热反应,温度越低,CO转化率越大,错误;C、减小容器体积等效于增大压强,平衡向正反应方向移动,CO体积分数减小,错误;D、正反应是放热反应,a<0,温度越低,平衡常数越大,正确。

练习册系列答案
相关题目
 PCl3(g)+Cl2(g) △H=+Q KJ/mol维持容器温度不变,测得容器内压强随反应时间的变化如图所示。下列说法正确的是( )
PCl3(g)+Cl2(g) △H=+Q KJ/mol维持容器温度不变,测得容器内压强随反应时间的变化如图所示。下列说法正确的是( )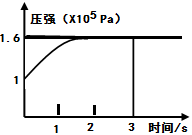
 N2(g)+2CO2(g) △H=-373.4kJ/mol
N2(g)+2CO2(g) △H=-373.4kJ/mol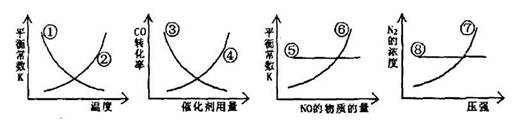
 E(g)
E(g)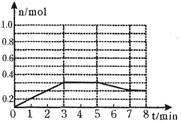
 CH3OH(g) △H
CH3OH(g) △H


 2C(g) 的△H<0,T2>T1
2C(g) 的△H<0,T2>T1 CH3COOH+C2H5OH已知该反应的速率随c(H+)的增大而加快。图为CH3COOC2H5的水解速率随时间的变化图。下列说法中正确的是( )
CH3COOH+C2H5OH已知该反应的速率随c(H+)的增大而加快。图为CH3COOC2H5的水解速率随时间的变化图。下列说法中正确的是( )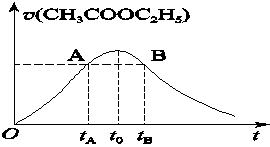
 N2O4,测得NO2转化率为a%。在温度、体积不变时,再通入1molNO2,待新平衡建立时,测得NO2的转化率为b%, a与b比较
N2O4,测得NO2转化率为a%。在温度、体积不变时,再通入1molNO2,待新平衡建立时,测得NO2的转化率为b%, a与b比较