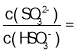题目内容
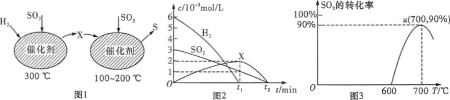
【题目】电导率是衡量电解质溶液导电能力大小的物理量,根据溶液电导率变化可以确定滴定反应的终点。在一定温度下,用0.1mol·L-1KOH溶液分别滴定体积均为20mL、浓度均为0.1mol ·L-1的盐酸和醋酸溶液,滴定曲线如图所示。下列有关判断正确的是
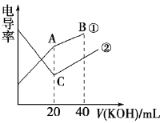
A. ①表示的是KOH溶液滴定醋酸溶液
B. A点的溶液中有c(CH3COO-)+c(OH-)-c(H+)=0.1 mol·L-1
C. C点水电离的c(OH-)大于A点水电离的c(OH-)
D. A、B、C三点溶液均有Kw=1.0×10-14
【答案】A
【解析】
A.溶液导电能力与离子浓度成正比,初始时HCl和醋酸浓度相同,CH3COOH只能部分电离,其导电能力较弱,则曲线①代表0.1mol/LKOH溶液滴定CH3COOH溶液的滴定曲线,故A正确;
B.A点溶质为CH3COOK,根据CH3COOK溶液中的电荷守恒可知:c(CH3COO-)+c(OH-)-c(H+)=c(K+)=0.05mol/L,故B错误;
C.酸或碱抑制水的电离,含有弱离子的盐促进水的电离,C点溶质为KCl,不影响水的电离,A点溶质为醋酸钠,醋酸根离子水解,促进了水的电离,所以C点水电离的c(OH-)小于A点水电离的c(OH-),故C错误;
D.题中并未说明是25℃下,所以A、B、C三点溶液的Kw不一定为1.0×10-14;此外,中和反应是放热反应,A、C两点是刚好中和的点,温度高于反应前的温度,则Kw要比反应前的大,更不会是1.0×10-14;故D错误;
故选A。

练习册系列答案
 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案
相关题目