题目内容
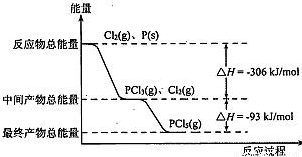
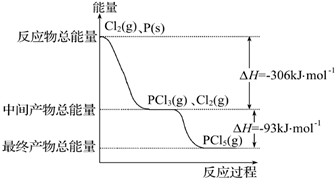
红磷(P)和Cl2发生反应生成PCl3和PCl5,反应过程和能量关系如图所示,图中的△H表示生成1mol产物的数据.已知PCl5分解为PCl3和Cl2是可逆反应.下列说法正确的是( )


分析:由图示可知反应物的总能量大于生成物的总能量,反应为放热反应,P和Cl2反应生成PCl3的热化学方程式为P(s)+
Cl2(g)═PCl3(g);△H=-306 kJ/mol,根据图中数据,可得P(s)+Cl2(g)=PCl5(g)△-399kJ/mol,结合外界条件对平衡移动的影响解答该题.
| 3 |
| 2 |
解答:解:A.反应为放热反应,升高温度平衡向逆方向移动,不利用PCl5生成,故A错误;
B.根据图中数据,可得P(s)+Cl2(g)=PCl5(g)△-399kJ/mol,则有反应2P(s)+5Cl2(g)═2PCl5(g)对应的反应热△H=-798 kJ?mol-1,故B正确;
C.P和Cl2反应生成PCl3的热化学方程式为P(s)+
Cl2(g)═PCl3(g);△H=-306 kJ/mol,题中物质的量与反应热不对应,故C错误;
D.其他条件不变,对于PCl5分解生成PCl3和Cl2的反应,热化学方程式为PCl5(g)=PCl3(g)+Cl2(g);△H=+93 kJ/mol,增大压强平衡向逆方向移动,PCl5的转化率减小,但平衡常数不变,故D错误.
故选B.
B.根据图中数据,可得P(s)+Cl2(g)=PCl5(g)△-399kJ/mol,则有反应2P(s)+5Cl2(g)═2PCl5(g)对应的反应热△H=-798 kJ?mol-1,故B正确;
C.P和Cl2反应生成PCl3的热化学方程式为P(s)+
| 3 |
| 2 |
D.其他条件不变,对于PCl5分解生成PCl3和Cl2的反应,热化学方程式为PCl5(g)=PCl3(g)+Cl2(g);△H=+93 kJ/mol,增大压强平衡向逆方向移动,PCl5的转化率减小,但平衡常数不变,故D错误.
故选B.
点评:本题考查热化学方程式的书写、外界条件对化学平衡移动的影响及反应热的计算等知识.解题中需注意:热化学方程式中没有标注各物质的聚集状态,各物质的物质的量与反应热没有呈现对应的比例关系,不能正确判断放热反应和吸热反应.

练习册系列答案
相关题目
红磷(P)和Cl2发生反应生成PCl3和PCl5,反应过程和能量关系如下图所示,图中的△H表示生成1 mol产物的数据。已知PCl5分解为PCl3和Cl2是可逆反应。下列说法正确的是( )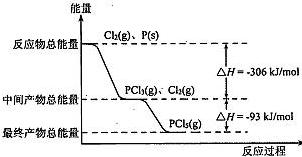
| A.其他条件不变,升高温度有利于PCl5生成 |
| B.反应2P(s)+5Cl2(g)===2PCl5(g)对应的反应热△H="-798" kJ/mol |
| C.P和Cl2反应生成PCl3的热化学方程式为2P(s)+3Cl2(g)=2PCl3(g)△H="-306" kJ/mol |
| D.其他条件不变,对于PCl5分解生成.PCl3和Cl2的反应,增大压强,PCl5的转化率减小,平衡常数K减小 |