题目内容
红磷(P)和Cl2发生反应生成PCl3和PCl5,反应过程和能量关系如图所示,图中的△H表示生成1mol产物的数据.已知PCl5分解为PCl3和Cl2是可逆反应.下列说法正确的是( )
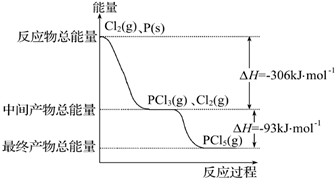

| A.其他条件不变,升高温度有利于PCl5生成 |
| B.反应2P(s)+5Cl2(g)═2PCl5(g)对应的反应热△H=-798 kJ?mol-1 |
| C.P和Cl2反应生成PCl3的热化学方程式为2P(s)+3Cl2(g)═2PCl3(g)△H=-306 kJ?mol-1 |
| D.其他条件不变,对于PCl5分解生成PCl3和Cl2的反应,增大压强,PCl5的转化率减小,平衡常数K减小 |
A.反应为放热反应,升高温度平衡向逆方向移动,不利用PCl5生成,故A错误;
B.根据图中数据,可得P(s)+Cl2(g)=PCl5(g)△-399kJ/mol,则有反应2P(s)+5Cl2(g)═2PCl5(g)对应的反应热△H=-798 kJ?mol-1,故B正确;
C.P和Cl2反应生成PCl3的热化学方程式为P(s)+
Cl2(g)═PCl3(g);△H=-306 kJ/mol,题中物质的量与反应热不对应,故C错误;
D.其他条件不变,对于PCl5分解生成PCl3和Cl2的反应,热化学方程式为PCl5(g)=PCl3(g)+Cl2(g);△H=+93 kJ/mol,增大压强平衡向逆方向移动,PCl5的转化率减小,但平衡常数不变,故D错误.
故选B.
B.根据图中数据,可得P(s)+Cl2(g)=PCl5(g)△-399kJ/mol,则有反应2P(s)+5Cl2(g)═2PCl5(g)对应的反应热△H=-798 kJ?mol-1,故B正确;
C.P和Cl2反应生成PCl3的热化学方程式为P(s)+
| 3 |
| 2 |
D.其他条件不变,对于PCl5分解生成PCl3和Cl2的反应,热化学方程式为PCl5(g)=PCl3(g)+Cl2(g);△H=+93 kJ/mol,增大压强平衡向逆方向移动,PCl5的转化率减小,但平衡常数不变,故D错误.
故选B.

练习册系列答案
 科学实验活动册系列答案
科学实验活动册系列答案
相关题目

