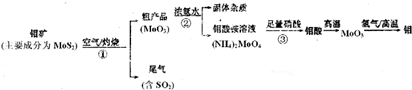
题目内容
1.400mL0.8mol/LH2SO4溶液(ρ=1.08g/cm3)和200mL98%浓硫酸(ρ=1,.84g/cm3)混合,所得H2SO4稀溶液的密度为1.2g/cm3,则混合后稀H2SO4的物质的量的浓度为6mol/L.分析 分别计算出两溶液中含有硫酸的物质的量、质量,然后根据V=$\frac{m}{ρ}$计算出混合液的体积,最后根据c=$\frac{n}{V}$计算出混合后稀H2SO4的物质的量的浓度.
解答 解:400 mL 0.8 mol•L-1 H2SO4溶液中含有硫酸的物质的量为:n(H2SO4)=0.8 mol•L-1×0.4 L=0.32 mol,
200 mL 98%浓H2SO4中的硫酸的物质的量为:n(H2SO4)=$\frac{1.84g•c{m}^{-3}×200mL×98%}{98g/mol}$=3.68 mol,
混合后溶液总体积为:V=$\frac{1.08g/c{m}^{3}×400mL+1.84g/c{m}^{-3}×200mL}{1.2×1{0}^{3}g•{L}^{-1}}$=$\frac{2}{3}$L,
所以稀释后c(H2SO4)=$\frac{0.32mol+3.68mol}{\frac{2}{3}L}$=6mol/L,
故答案为:6.
点评 本题考查了物质的量浓度的计算,题目难度中等,明确物质的量浓度的概念及表达式为解答关键,试题有利于培养学生的分析能力及化学计算能力.

练习册系列答案
 中考解读考点精练系列答案
中考解读考点精练系列答案 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案
相关题目
3.下列物质的分类正确的是( )
| 碱 | 酸 | 盐 | 碱性氧化物 | 酸性氧化物 | |
| A | Na2CO3 | H2SO4 | NaOH | SO2 | CO2 |
| B | NaOH | HCl | NaCl | Na2O | CO2 |
| C | NaOH | CH3COOH | CaF2 | CO | SO2 |
| D | KOH | HNO3 | CaCO3 | CaO | SO2 |
10.下列物质能导电,但属于电解质的是( )
| A. | 纯净的硫酸 | B. | KNO3 溶液 | C. | NH4HCO3固体 | D. | 熔融的KCl |
11.设NA代表阿伏加德罗常数,下列说法正确的是( )
| A. | 标准状况下,H2的气体摩尔体积约为22.4L | |
| B. | 标准状况下,22.4L的CO2和O2组成的混合物中,含氧原子数为2NA | |
| C. | 1mol/L CaCl2溶液中含有的氯离子数目为2NA | |
| D. | 18gNH4+中含有10NA个质子 |