题目内容
在室温下,下列五种溶液:
①0.1mol/L NH4Cl
②0.1mol/L CH3COONH4
③0.1mol/L NH4HSO4
④0.1mol/L NH3·H2O和0.1mol/L NH4Cl的混合液
请根据要求填写下列空白:
(1)溶液①呈酸性,其原因是_______________________________(用离子方程式表示)
(2)比较溶液②、③中c(NH4+)的大小关系是② ③(填“>”“=”或“<”)。
(3)在溶液④中, 离子的浓度为0.1mol/L;NH3·H2O和 离子的浓度之和为0.2 mol/L。
(4)室温下,测得溶液②的pH=7, CH3COO-与NH4+浓度的大小关系是:
c(CH3COO-) c(NH4+)(填“>”“=”或“<”)。
(1) NH4++2H2O NH3·H2O+H+ (2) < (3) Cl- NH4+ (4)=
NH3·H2O+H+ (2) < (3) Cl- NH4+ (4)=
解析试题分析:(1)呈酸性的原因是铵根离子水解,NH4++2H2O NH3·H2O+H+
NH3·H2O+H+
(2)②0.1mol/L CH3COONH4 中醋酸根离子促进铵根离子水解,使铵根离子浓度最小,③0.1mol/L NH4HSO4 中氢离子抑制铵根离子水解;所以c(NH4+)的大小关系是②<③
(3)在溶液④中,Cl-离子的浓度为0.1mol/L, NH3·H2O和NH4+离子的浓度之和为0.2 mol/L
(4)溶液②中电荷守恒的式子为:[CH3COO-]+[OH-]=[H+] + [NH4+] 室温下pH=7则[OH-]=[H+],所以[CH3COO-]= [NH4+].
考点:考查盐类水解及离子浓度大小的比较

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案现有浓度均为0.1 mol·L-1的下列溶液:
①硫酸、②醋酸溶液、③氢氧化钠溶液、④氯化铵溶液、⑤醋酸铵溶液、⑥硫酸铵溶液、⑦硫酸氢铵溶液、⑧氨水,请回答下列问题:
(1)①、②、③、④四种溶液中由水电离出的H+浓度由大到小的顺序是(填序号)________。
(2)④、⑤、⑦、⑧四种溶液中NH4+浓度由大到小的顺序是(填序号)________。
(3)将③和④等体积混合后,混合液中各离子浓度关系正确的是________。
| A.c(Na+)=c(Cl-)>c(OH-)>c(NH4+) |
| B.c(Na+)=0.1 mol·L-1 |
| C.c(Na+)+c(NH4+)=c(Cl-)+c(OH-) |
| D.c(H+)>c(OH-) |
某学生用0.10 mol/L标准NaOH溶液滴定某浓度的盐酸。记录数据如下:
| 实验序号 | 待测液体积(mL) | 所消耗NaOH标准液的体积(mL) | |
| 滴定前 | 滴定后 | ||
| 1 | 20.00 | 0.50 | 20.54 |
| 2 | 20.00 | 6.00 | 26.00 |
| 3 | 20.00 | 1.40 | 21.36 |
(1)滴定时选用酚酞试液作指示剂,如何判断滴定达到终点 。
(2)盐酸的物质的量浓度为_____________
(3)碱式滴定管尖嘴部分有气泡,滴定后消失,对测定结果的影响是 (填“偏高”或“偏低”或“无影响”,下同)。
(4)某同学用已知准确浓度的高锰酸钾溶液滴定溶液中Fe2+的浓度,高锰酸钾溶液应盛放在 中(填“甲”或“乙”),该反应的离子方程式为: 。

(1)常温下,将NH3·H2O与盐酸等体积混合,实验数据如下:
| 组别 | NH3·H2O | HCl | 混合溶液的pH值 |
| 甲 | c(NH3·H2O)=0.1mol·L-1 | c(HCl)=0.1mol·L-1 | pH=a |
| 乙 | NH3·H2O的pH=12 | HCl的pH=2 | pH=b |
| 丙 | c(NH3·H2O)="A" mol·L-1 | c(HCl)=0.1mol·L-1 | pH=c |
针对甲、乙、丙三组实验,回答下列问题:
①甲组反应后,溶液中离子浓度的大小顺序为__________________;
②乙组b 7(填“>”、“<”或“=”)
③丙组溶液混合后c=7,A 0.1mol·L-1(填“>”、“<”或“=”)
④甲中a=6,混合溶液中c(Cl-)-c(NH4+)= ____________mol·L-1 (列式表示结果,不能做近似计算)。(2)常温下,在20.0mL 0.20mol/LCH3COONa溶液中滴加0.20mol/L的稀盐酸。溶液的PH 的变化关系如右图所示。
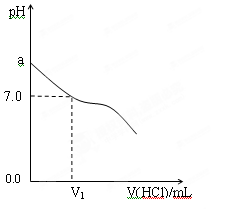
①a >7.0的理由是(用离子方程式表示) 。
②当加入的盐酸的体积为20.0mL时,测定溶液中的c(H+)为1.3×10-3 mol/L,求CH3COOH的电离平衡常数Ka (设混合后的体积为二者的体积之和,计算结果保留两位有效数字。)
 Fe3+(aq)+3OH-(aq) ; ΔH=" a" kJ?mol-1
Fe3+(aq)+3OH-(aq) ; ΔH=" a" kJ?mol-1