题目内容
10.甲烷燃料电池以铂为电极、KOH溶液为电解质溶液,在两极区分尉通入甲烷和氧气即可产生电流.下列叙述正确的是( )| A. | 通入甲烷的电极为正极 | |
| B. | 电池工作一段时间后,溶液的碱性增强 | |
| C. | 负极的电极反应:CH4+l0OH--8e-=CO32-+7H2O | |
| D. | 通入甲烷的电极的电极反应:O2+2H2O+4e-=4OH- |
分析 甲烷在反应时失电子被氧化,应为原电池负极反应,电极方程式为CH4+10OH--8e-=CO32-+7H2O,通入氧气的一极为原电池的正极,发生还原反应,电极方程式为02+2H2O+4e-=40H-,总反应式为CH4+2O2+2KOH═K2CO3+3H2O,以此解答该题.
解答 解:A、通甲烷的一极发生氧化反应,是负极,故A错误;
B、总反应式为CH4+2O2+2KOH═K2CO3+3H2O,所以消耗氢氧根,则碱性减弱,故B错误;
C、甲烷在反应时失电子被氧化,应为原电池负极反应,电极方程式为CH4+10OH--8e-=CO32-+7H2O,故C正确;
D、甲烷在反应时失电子被氧化,应为原电池负极反应,电极方程式为CH4+10OH--8e-=CO32-+7H2O,故D错误;
故选C.
点评 本题考查碱性甲烷电池的工作原理,题目难度中等,本题中注意把握电极反应式的书写,正确判断两极的化学反应,在学习中注意积累转移电子与参加反应的物质的量的关系.

练习册系列答案
相关题目
12.已知Cl2、Br2、FeCl3、I2的氧化性依次减弱.下列反应不可能发生的是( )
| A. | Cl2+2H Br=2HCl+Br2 | B. | Cl2+FeI2=FeCl2+I2 | ||
| C. | 3Cl2+6FeI2=2FeCl3+4FeI3 | D. | 2Fe3++2I-=2Fe2++I2 |
1.用氮化硅(Si3N4)陶瓷代替金属制造发动机的耐热部件,能大幅度提高发动机的热效率.工业上用化学气相沉积法制备氮化硅的反应如下:3SiCl4(g)+2N2(g)+6H2(g)$\frac{\underline{\;高温\;}}{\;}$Si3N4(s)+12HCl(g)△H<0,一定温度下,恒容密闭容器中进行该反应,下列措施能增大正反应的反应速率的是( )
| A. | 分离出少量氮化硅 | B. | 降低温度 | ||
| C. | 充入氮气 | D. | 充入氦 |
18.对一个有气体参与的反应,下列能加快反应速率且不改变活化分子百分数的是( )
| A. | 定容容器中通入惰性气体 | B. | 增大压强 | ||
| C. | 升温 | D. | 加入催化剂 |
19.分子式为C3H8O的醇与C4H8O2的羧酸浓H2SO4存在时共热生成的酯有( )
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
20.苹果酸的结构简式为 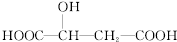 ,下列说法正确的是( )
,下列说法正确的是( )
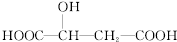 ,下列说法正确的是( )
,下列说法正确的是( )| A. | 1mol苹果酸可与3 mol NaOH发生中和反应 | |
| B. | 1mol苹果酸与足量金属Na反应生成1mol H2 | |
| C. | 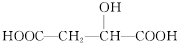 与苹果酸互为同分异构体 与苹果酸互为同分异构体 | |
| D. | 苹果酸中能发生酯化反应的官能团有2种 |
 (不考虑立体结构).
(不考虑立体结构).


 D
D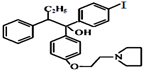
 有多种同分异构体,其中满足①遇FeCl3显色②苯环上的一溴取代物只有一种,符合条件的同分异构体数目有6种.
有多种同分异构体,其中满足①遇FeCl3显色②苯环上的一溴取代物只有一种,符合条件的同分异构体数目有6种. 中任一种.
中任一种. +
+ $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$ +HBr.
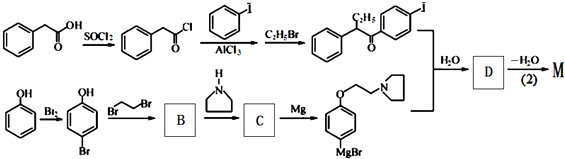
+HBr. 及含二个碳原子的有机化合物为原料,制备芳香醇
及含二个碳原子的有机化合物为原料,制备芳香醇 的合成路线
的合成路线 (不超过5步反应).
(不超过5步反应). ,(2)H2O2:
,(2)H2O2: ,
, ,(4)CO2:
,(4)CO2: .
.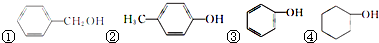 (填序号)
(填序号)