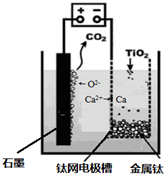
题目内容
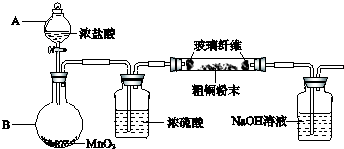
已知:MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O.一定质量的二氧化锰溶解在100mL过量的浓盐酸中,当反应生成 4.48L 氯气(标况)时,剩余溶液中盐酸的浓度为1mol/L(假设反应前后体积不变).请计算:
(1)反应耗用MnO2的质量
(2)被氧化的HCl物质的量
(3)原浓盐酸的物质的量浓度.
| ||
(1)反应耗用MnO2的质量
(2)被氧化的HCl物质的量
(3)原浓盐酸的物质的量浓度.
分析:利用氯气在标况下的体积来计算其物质的量,然后利用化学反应方程式计算MnO2的质量、参加反应的HCl的物质的量,再利用剩余的盐酸进一步计算盐酸的浓度,由方程式可知盐酸有一半被氧化.
解答:解:氯气的物质的量为
=0.2mol,
设耗用二氧化锰xmol,参加反应的盐酸ymol,则
MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O
1 4 1
x y 0.2mol
=
、
=
,
解得x=0.2mol,y=0.8mol,
(1)反应耗用MnO2的质量为0.2mol×87g/mol=17.4g,
答:反应耗用MnO2的质量为17.4g;
(2)被氧化的HCl物质的量为0.8mol×
=0.4mol,
答:被氧化的HCl物质的量为0.4mol;
(3)原溶液中HCl的物质的量为0.8mol+0.1L×1mol/L=0.9mol,
原浓盐酸的物质的量浓度为c(HCl)=
=9mol/L,
答:原浓盐酸的物质的量浓度为9mol/L.
| 4.48L |
| 22.4L/mol |
设耗用二氧化锰xmol,参加反应的盐酸ymol,则
MnO2+4HCl(浓)
| ||
1 4 1
x y 0.2mol
| 1 |
| 1 |
| x |
| 0.2mol |
| 4 |
| 1 |
| y |
| 0.2mol |
解得x=0.2mol,y=0.8mol,
(1)反应耗用MnO2的质量为0.2mol×87g/mol=17.4g,
答:反应耗用MnO2的质量为17.4g;
(2)被氧化的HCl物质的量为0.8mol×
| 1 |
| 2 |
答:被氧化的HCl物质的量为0.4mol;
(3)原溶液中HCl的物质的量为0.8mol+0.1L×1mol/L=0.9mol,
原浓盐酸的物质的量浓度为c(HCl)=
| 0.9mol |
| 0.1L |
答:原浓盐酸的物质的量浓度为9mol/L.
点评:本题考查学生利用化学反应方程式的计算,难度不大,明确氯气的物质的量代入化学反应方程式来计算是解答的关键.

练习册系列答案
 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案
相关题目
 已知KMnO4、MnO2在酸性条件下均能将草酸钠(Na2C2O4)氧化:
已知KMnO4、MnO2在酸性条件下均能将草酸钠(Na2C2O4)氧化: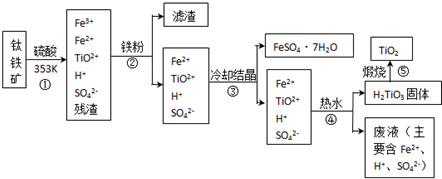

 CuCl42-(aq)+4H2O(l)
CuCl42-(aq)+4H2O(l)
