题目内容
【题目】下列表达方式正确的是( )
A.用电子式表示氯化氢分子的形成过程: ![]()
B.硫离子结构示意图: 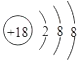
C.氢氧根的电子式: ![]()
D.HClO的结构式:H﹣O﹣Cl
【答案】D
【解析】解:A.氯化氢为共价化合物,用电子式表示氯化氢分子的形成过程为: ![]() ,故A错误; B.硫离子的核电荷数为16,最外层达到8电子稳定结构,硫离子正确的离子结构示意图为:
,故A错误; B.硫离子的核电荷数为16,最外层达到8电子稳定结构,硫离子正确的离子结构示意图为: ![]() ,故B错误;
,故B错误;
C.氢氧根离子带有1个单位负电荷,其正确的电子式为 ![]() ,故C错误;
,故C错误;
D.HClO的中心原子为O原子,其结构式为:H﹣O﹣Cl,故D正确;
故选D.
A.氯化氢为共价化合物,分子中不存在阴阳离子;
B.硫离子的核电荷数为16,不是18;
C.氢氧根离子为阴离子,电子式中需要标出所带电荷;
D.次氯酸分子中含有1个H﹣O键和1个O﹣Cl键.

 小题狂做系列答案
小题狂做系列答案【题目】下图是元素周期表的一部分
A | |||||||||||||||||
B | C | D | E | F | |||||||||||||
H | I | J | K | ||||||||||||||
L | M | O |
(1)元素L的价电子排布图为__________,元素M的原子结构示意图为________,位于元素周期表五个区域中的_______区。上述元素中电负性最强的是_______(用元素符号表示),C、D、E、F第一电离能的大小顺序为____________(用元素符号表示)。
(2)D的氢化物和J氢化物沸点较高的是______(填化学式),稳定性更强的是______(填化学式)。
(3)某些不同族元素的性质也有一定的相似性,如上表中元素I与元素B的单质有相似的性质。写出元素单质B与NaOH溶液反应的离子方程式___________________________。
(4)A、E、H、J四种元素的原子半径由大到小的排列顺序为___________________;E、F、H、K四种元素简单离子的半径由大到小的排列顺序为________________用元素符号表示)。
(5)能证明元素K比元素J的非金属性强的事实是______________(填序号)。
A.常温下K单质的密度小于J单质的密度
B.K元素的气态氢化物比J元素的气态氢化物更稳定
C.K单质与氢气反应的程度比J单质与氢气反应的程度更剧烈
D.K元素的氧化物对应的水化物酸性强于J元素的氧化物对应的水化物