题目内容
【题目】X、Y、W、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示.已知X的一种核素的质量数为18,中子数为10,Y和Ne原子的核外电子总数相差1;W的单质是一种常见的半导体材料;Z的非金属性在同周期主族元素中最强. 
(1)W位于元素周期表中第周期第族画出X的阴离子的结构示意图
(2)Z的氢化物和溴化氢相比,较稳定的是(写化学式);Z的氢化物与氟化氢相比,沸点较高的是(写化学式).
(3)Y的金属性与Mg的金属性相比,(写化学式)的金属性强,请用实验证明它们金属性的相对强弱: .
(4)写出Y的最高价氧化物对应的水化物与Z的最高价氧化物对应的水化物发生反应的化学反应方程式
【答案】
(1)三;ⅤA;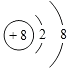
(2)HCl;HF
(3)Na;Na与冷水剧烈反应,而Mg与冷水反应较慢
(4)NaOH+HClO4=NaClO4+H2O
【解析】解:X的一种核素的质量数为18,中子数为10,则X的质子数为8,则X为O元素;Y和Ne原子的核外电子数相差1时,Y可能为F或Na,由于原子半径X<Y,则Y为Na元素;W的单质是一种常见的半导体材料,则W为Si元素;Z是同周期中非金属性最强的元素,且原子半径小于Si、大于O,则Z为Cl元素,根据分析可知:X为O元素、Y为Na元素、Z为Cl元素、W为Si元素,(1)W为Si元素,Si的原子序数为14,位于周期表中第三周期第ⅣA族;
X为氧元素,氧离子的核电荷数为8,核外电子总数为10,氧离子结构示意图为: 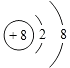 ,所以答案是:三;ⅣA;
,所以答案是:三;ⅣA; 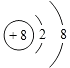 ;(2)Z为Cl元素,由于非金属性Cl>Br,则气态氢化物稳定的是HCl;由于HF中存在氢键,则HF的熔沸点大于HCl,所以答案是:HCl; HF;(3)Y为钠元素,Na与冷水剧烈反应,而Mg与冷水反应较慢,所以金属钠的活泼性大于Mg,所以答案是:Na;Na与冷水剧烈反应,而Mg与冷水反应较慢(其他合理答案也可);(4)Y为Na、Z为Cl,Y的最高价氧化物对应的水化物为NaOH,Z的最高价氧化物对应的水化物为HClO4 , 氢氧化钠与高氯酸反应的化学反应方程式为:NaOH+HClO4=NaClO4+H2O,所以答案是:NaOH+HClO4=NaClO4+H2O.
;(2)Z为Cl元素,由于非金属性Cl>Br,则气态氢化物稳定的是HCl;由于HF中存在氢键,则HF的熔沸点大于HCl,所以答案是:HCl; HF;(3)Y为钠元素,Na与冷水剧烈反应,而Mg与冷水反应较慢,所以金属钠的活泼性大于Mg,所以答案是:Na;Na与冷水剧烈反应,而Mg与冷水反应较慢(其他合理答案也可);(4)Y为Na、Z为Cl,Y的最高价氧化物对应的水化物为NaOH,Z的最高价氧化物对应的水化物为HClO4 , 氢氧化钠与高氯酸反应的化学反应方程式为:NaOH+HClO4=NaClO4+H2O,所以答案是:NaOH+HClO4=NaClO4+H2O.

 名校课堂系列答案
名校课堂系列答案
