题目内容
【题目】下图中所涉及的A、B、C、D、E、F和G等都是中学化学教材中常见物质。其中B、E为金属单质,D为气体。反应①②是置换反应,反应①②③均在高温下进行。A为常温下最常见的液体,C有磁性,E、F既能溶于NaOH又能溶于HCl。
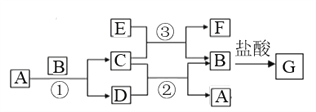
(1)C的俗名_____________,E与足量盐酸反应的离子方程式_________________;
(2)反应③化学方程式_______________________;E加入NaOH溶液中反应的离子反应方程式_______________________;
(3)检验G溶液中金属阳离子的方法________________________;
(4)F与氢氧化钠反应的化学方程式为_____________________________。
【答案】 磁性氧化铁 2Al +6H+=2Al 3++3 H2↑ 8Al+3Fe3O4![]() 9Fe+4Al2O3 2Al+2OH-+2H2O=2AlO2-+3H2 取少量G溶液置于试管中,滴加1滴硫氰化钾溶液,无明显现象,再滴加酸化的过氧化氢溶液,溶液变红。(取少量G溶液于试管中,滴加2-3滴铁氰化钾溶液,出现特征蓝色沉淀或其他合理答案均可) Al2O3+2NaOH=2NaAlO2+H2O
9Fe+4Al2O3 2Al+2OH-+2H2O=2AlO2-+3H2 取少量G溶液置于试管中,滴加1滴硫氰化钾溶液,无明显现象,再滴加酸化的过氧化氢溶液,溶液变红。(取少量G溶液于试管中,滴加2-3滴铁氰化钾溶液,出现特征蓝色沉淀或其他合理答案均可) Al2O3+2NaOH=2NaAlO2+H2O
【解析】试题分析:由题意知,A、B、C、D、E、F和G等都是中学化学教材中常见物质,反应①②是置换反应,反应①②③均在高温下进行。A为常温下最常见的液体,则A为水;C有磁性,则C为四氧化三铁;;B、E为金属单质,D为气体,由反应①可知,D为氢气、B为铁; E、F既能溶于NaOH又能溶于HCl,则E为铝、F为氧化铝、G为氯化亚铁。
(1)四氧化三铁的俗名为磁性氧化铁,铝与足量盐酸反应的离子方程式2Al +6H+=2Al 3++3 H2↑;
(2)反应③化学方程式为8Al+3Fe3O4![]() 9Fe+4Al2O3;铝加入NaOH溶液中反应的离子反应方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑;
9Fe+4Al2O3;铝加入NaOH溶液中反应的离子反应方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑;
(3)检验氯化亚铁溶液中金属阳离子的方法是:取少量该溶液置于试管中,滴加1滴硫氰化钾,无明显现象,再滴加酸化的过氧化氢溶液,溶液变红。(取少量G溶液于试管中,滴加2-3滴铁氰化钾溶液,出现特征蓝色沉淀或其他合理答案均可);
(4)氧化铝与氢氧化钠反应的化学方程式为Al2O3+2NaOH=2NaAlO2+H2O。

【题目】目前工业上可利用CO或CO2来生产燃料甲醇,某研究小组对下列有关甲醇制取的三条化学反应原理进行探究.已知在不同温度下的化学反应平衡常数(K1、K2、K3)如表所示:
目前工业上可利用CO或CO2来生产燃料甲醇,某研究小组对下列有关甲醇制取的三条化学反应原理进行探究.已知在不同温度下的化学反应平衡常数(K1、K2、K3)如表所示:
化学反应 | 焓变 | 平衡常数 | 温度/℃ | ||
500 | 700 | 800 | |||
①2H2(g)+CO(g)CH3OH(g) | △H1 | K1 | 2.5 | 0.34 | 0.15 |
②CO2(g)+H2(g)CO(g)+H2O(g) | △H2 | K2 | 1.0 | 1.70 | 2.52 |
③CO2(g)+3H2(g)CH3OH(g)+H2O(g) | △H3 | K3 | |||
请回答下列问题:
(1)反应②是(填“吸热”或“放热”)反应.
(2)根据反应①与②可推导出K1、K2与K3之间的关系,则K3=(用K1、K2表示),
△H3═(用△H1、△H2表示);根据反应③判断△S0(填“>”、“=”或“<”),在(填“较高”或“较低”)温度下有利于该反应自发进行.
(3)要使反应③在一定条件下建立的平衡正向移动,可采取的措施有(填写字母序号).
A.缩小反应容器的容积
B.扩大反应容器的容积
C.升高温度
D.降低温度
E.使用合适的催化剂
F.从平衡体系中及时分离出CH3OH
(4)500°C时,测得反应③在某时刻,CO2(g)、H2(g)、CH3OH(g)、H2O(g)的浓度分别为0.1molL﹣1、0.3molL﹣1、0.3molL﹣1、0.15molL﹣1 , 则此时v正v逆(填“>”、“=”或“<”).
(5)根据表格测得焓变,下列能量关系图合理的是 . 
(6)某兴趣小组研究反应②的逆反应速率在下列不同条件下随时间的变化曲线,开始时升温,t1时平衡,t2时降压,t3时增加CO浓度,t4时又达到平衡.请画出t2至t4的曲线.