题目内容
【题目】常温下,在两份相同的Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如图所示。下列分析不正确的是
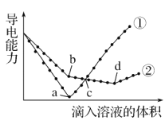
A.b点,水电离产生的c(H+)< 10-7 mol/L B.①代表滴加H2SO4溶液的变化曲线
C.a、d两点对应的溶液均显中性 D.c点,两溶液中含有相同量的 OH-
【答案】D
【解析】
试题分析:两个反应的方程式分别为:①Ba(OH)2+H2SO4=BaSO4+2H2O,②Ba(OH)2+NaHSO4=NaOH+BaSO4 +H2O、NaOH+NaHSO4=Na2SO4+H2O。A、b点是加入硫酸氢钠进行反应②,溶液中含有氢氧化钠,水的电离受到抑制,水电离产生的c(H+)< 10-7 mol/L,故A正确;B、根据反应的化学方程式可知,当氢氧化钡恰好和硫酸完全反应时,溶液的导电能力最小,故①代表滴加硫酸时的变化曲线,故B正确;C、a点为钡离子和硫酸根离子完全沉淀,d为硫酸钠溶液,溶液都显中性,故C正确;D、c点①曲线为硫酸,②曲线为氢氧化钠和硫酸钠,因为硫酸根离子浓度相同,②中的钠离子浓度大于①中氢离子浓度,所以溶液中的氢氧根离子浓度不相同,故D错误。答案选D。

练习册系列答案
 综合自测系列答案
综合自测系列答案
相关题目