��Ŀ����
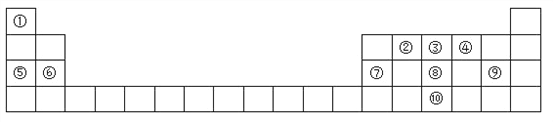
����Ŀ��Ԫ�����ڱ���ѧϰ���ʽṹ�����ʵ���Ҫ���ߣ���ͼ��Ԫ�����ڱ���һ���֣������Ԫ�آ٩����ڱ��е�λ�ûش��������⣮
��1���������ԭ�ӽṹʾ��ͼ��______
��2���ۡ��ܡ������̬�⻯���ȶ�����С�����˳���ǣ�______���ѧʽ��
��3���ࡢ�������������Ӧˮ���������ǿ��˳���ǣ�______���ѧʽ��
��4���ڡ�����Ԫ���γɵ�AB2�����ʵĵ���ʽ�ǣ�______
��5���١��ܡ��ݡ����е�ijЩԪ�ؿ��γɼȺ����Ӽ��ֺ����ۼ��Ļ����д������һ�ֻ�����Ļ�ѧʽ��______
��6��д���ߵĵ�����ݵ�����������Ӧˮ���ﷴӦ�����ӷ���ʽ��______
���𰸡�  PH3��NH3��H2O HClO4��H3PO4
PH3��NH3��H2O HClO4��H3PO4 ![]() NaOH��NaClO��Na2O2 2Al+2OH-+6H2O=2[Al(OH)4]-+3H2��
NaOH��NaClO��Na2O2 2Al+2OH-+6H2O=2[Al(OH)4]-+3H2��
�����������ݢ١���Ԫ�����ڱ��е�λ�ÿ�֪�ֱ���H��C��N��O��Na��Mg��Al��P��Cl��As����
��1��As��ԭ��������33��ԭ�ӽṹʾ��ͼΪ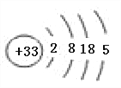 ����2���ۡ��ܡ���ķǽ�����ǿ���ǣ�O��N��P��������̬�⻯���ȶ�����С�����˳����PH3��NH3��H2O����3����Ԫ�طǽ�����ǿ���ף����Ԣࡢ�������������Ӧˮ���������ǿ��˳����HClO4��H3PO4��
����2���ۡ��ܡ���ķǽ�����ǿ���ǣ�O��N��P��������̬�⻯���ȶ�����С�����˳����PH3��NH3��H2O����3����Ԫ�طǽ�����ǿ���ף����Ԣࡢ�������������Ӧˮ���������ǿ��˳����HClO4��H3PO4��
��4��C��O��Ԫ���γɵ�AB2��������CO2�����ڹ��ۻ��������ʽ��![]() ����5��H��O��Na��Cl�е�ijЩԪ�ؿ��γɼȺ����Ӽ��ֺ����ۼ��Ļ����������NaOH��NaClO��Na2O2����6���ߵĵ�������ݵ�����������Ӧˮ�����������Ʒ�Ӧ�����ӷ���ʽΪ2Al+2OH-+6H2O=2[Al(OH)4]-+3H2����
����5��H��O��Na��Cl�е�ijЩԪ�ؿ��γɼȺ����Ӽ��ֺ����ۼ��Ļ����������NaOH��NaClO��Na2O2����6���ߵĵ�������ݵ�����������Ӧˮ�����������Ʒ�Ӧ�����ӷ���ʽΪ2Al+2OH-+6H2O=2[Al(OH)4]-+3H2����

 ӥ�ɽ̸��νӽ̲ĺӱ�����������ϵ�д�
ӥ�ɽ̸��νӽ̲ĺӱ�����������ϵ�д�