��Ŀ����
����Ŀ����ҵ�ϣ����������з�Ӧ�ϳ������谷�� CaO+3C ![]() CaC2+CO����CaC2+N2
CaC2+CO����CaC2+N2 ![]() CaCN2+C��CaCN2+2H2O=NH2CN+Ca��OH��2 �� NH2CN��ˮ��Ӧ��������[CO��NH2��2]���������غϳ������谷��
CaCN2+C��CaCN2+2H2O=NH2CN+Ca��OH��2 �� NH2CN��ˮ��Ӧ��������[CO��NH2��2]���������غϳ������谷��
��1��д����Ca��ͬһ���ڵ�Crԭ�ӵ���Χ�����Ų�ʽ ��
��2��д��CaC2��������C22����һ�ֵȵ�����Ļ�ѧʽ ��
��3��1mol ���ط���[CO��NH2��2]�к��еĦм���Ҽ�����Ŀ֮��Ϊ ��
��4�������谷�׳ơ�����������ṹΪ  �����е�ԭ�ӵ��ӻ���ʽ�� ��
�����е�ԭ�ӵ��ӻ���ʽ�� ��
��5��CaO������ͼ��ʾ��CaO��������O2�����������Ca2+�ĸ���Ϊ �� CaO������۵��NaCl������۵�ߵ���Ҫԭ���� �� 
���𰸡�
��1��[Ar]3d54s1
��2��N2��CO��CN������дһ��
��3��1��7
��4��sp2��sp3
��5��6��CaO������Ca2+��O2���ĵ������NaCl������Na+��Cl����CaO����ľ����ܴ�
���������⣺��1��Crԭ�Ӻ��������Ϊ24����������Ų�ʽΪ[Ar]3d54s1 �� ���Դ��ǣ�[Ar]3d54s1����2��ԭ��������ͬ���۵����������������������ͬ������Ϊ�ȵ����壬��C22����һ�ֵȵ�����Ļ�ѧʽΪ��N2��CO��CN���ȣ����Դ��ǣ�N2��CO��CN������дһ������3��CO��NH2��2��Cԭ������ԭ��֮���γ�C=O˫����Cԭ����Nԭ��֮���γ�2��C��N������Nԭ����Hԭ��֮�乲�γ�4��N��H���������ǦҼ���˫���к���1���Ҽ���1���м�������1mol ���ط���[CO��NH2��2]�к��еĦм���Ҽ�����Ŀ֮��Ϊ1��7�����Դ��ǣ�1��7����4������Nԭ���γ�2���Ҽ�������1�Թµ��Ӷԣ��ӻ������ĿΪ3����ȡsp2�ӻ���������Nԭ���γ�3���Ҽ�������1�Թµ��Ӷԣ��ӻ������ĿΪ4����ȡsp3�ӻ������Դ��ǣ�sp2��sp3����5��������O2���о�����֮�����Ca2+λ�����ģ�����֮�����Ca2+����6��CaO������۵��NaCl������۵�ߵ���Ҫԭ���ǣ�CaO������Ca2+��O2���ĵ������NaCl������Na+��Cl����CaO����ľ����ܴ� ���Դ��ǣ�6��CaO������Ca2+��O2���ĵ������NaCl������Na+��Cl����CaO����ľ����ܴ�

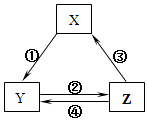
����Ŀ�������и��������У�����֮��ͨ��һ����Ӧ����ʵ����ͼ��ʾת����������Ӧ������ȷ���ǣ�������
ѡ�� | X | Y | Z | ��ͷ���������ֵķ�Ӧ���� |
A | SiO2 | Na2SiO3 | H2SiO3 | ����Na2CO3���� |
B | Na | Na2O2 | NaCl | �ڼ�H2O |
C | NO | NO2 | HNO3 | ����C���� |
D | Al2O3 | NaAlO2 | Al��OH��3 | ����NaOH |
A.A
B.B
C.C
D.D





