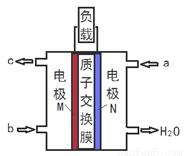
题目内容
下列说法中错误的是
A. 历史上很多种元素是通过原子光谱发现的
B. 鉴别晶体与非晶体,最为科学的方法是X射线衍射法
C. 前36号元素中基态电子排布未成对电子数最多的元素, 在第四周期第IIIB族
D. 金属性越强的金属元素,第一电离能不一定就越小
烟气的脱硫(除SO2)技术和脱硝(除NOx)技术都是环境科学研究的热点。
(1)烟气脱硫、脱硝的环境意义是______________________;
(2)一种选择性催化脱硝(NO2)的原理为:6NO2+8NH3 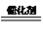 7N2+12H2O
7N2+12H2O
① 上述反应中被还原的元素是_________(填元素符号),反应中每转移3mol电子,生成标准状况下N2的体积为____________;
② 超音速飞机排放的尾气是平流层中NOx的主要来源.它们破坏臭氧层的主要机理为:
Ⅰ 、O3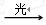 O+O2 Ⅱ 、NO+O3→NO2+O2 Ⅲ 、 NO2+O→ NO+O2
O+O2 Ⅱ 、NO+O3→NO2+O2 Ⅲ 、 NO2+O→ NO+O2
上述反应中NOx所起的作用是_____________;
(3)下表列出了2种燃煤烟气脱硫方法的原理。
方法Ⅰ | 用氨水将SO2转化为NH4HSO3,再氧化成(NH4)2SO4 |
方法Ⅱ | 用生物质热解气(主要成分CO、CH4、H2)将SO2在高温下还原成单质硫 |
①方法Ⅰ中用氨水吸收燃煤烟气中的SO2转化为NH4HSO3,是利用了SO2的___________性质(选填字母编号)。
A.漂白性 B.氧化性  C.还原性 D.酸性氧化物
C.还原性 D.酸性氧化物
②方法Ⅰ中氨水吸收燃煤烟气中SO2的化学反应为:2NH3+SO2+H2O=(NH4)2SO3
(NH4)2SO3+SO2+H2O=2NH4HSO3,能提高燃煤烟气中SO2去除率的措施有______(填字母).
A.增大氨水浓度 B.升高反应温度
C.使燃煤烟气与氨水充分接触 D.通入空气使HSO3-转化为SO42-
③采用方法Ⅰ脱硫,并不需要预先除去燃煤烟气中大量的CO2,原因是_________________(用离子方程式表示)。