题目内容
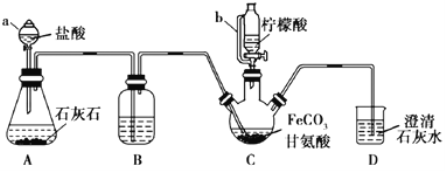
【题目】某同学设计如下实验方案,以分离KNO3和Ba(NO3)2两种固体混合物试回答下列问题

供选试剂:Na2SO4溶液、Na2CO3溶液、K2CO3溶液、K2SO4溶液、硫酸、硝酸
(1)试剂a是_______加入试剂b所发生反应的离子方程式为___________________________
(2)该方案能否达到实验目的:__________________________(填能或不能)若不能,应如何改进?__________________________(若能此问不用回答)
(3)若要测定原混合物中Ba(NO3)2的质量分数,除了要准确称量混合物的质量外至少还要获得的数据是__________的质量
(4)用所制备的KNO3固体配制0.1 mol/L KNO3溶液450mL,回答下列问题:
①配制过程中需要用到的玻璃仪器有烧杯、量筒、胶头滴管、______________
②需要用托盘天平称量_______g KNO3固体)
③下列情况会使所配溶液浓度偏低的是________
A.称量固体时,砝码与药品的位置放反了,即“左码右物”
B.使用有少量蒸馏水的容量瓶
C.定容时俯视刻度线观察液面
D.洗涤和转移时有液体外溅
【答案】K2CO3溶液 ![]() 不能 应在操作②的滤液中加入稍过量(或适量)硝酸后再蒸发结晶 干燥的沉淀A1,或固体B 500mL容量瓶、玻璃棒 5.1 AD
不能 应在操作②的滤液中加入稍过量(或适量)硝酸后再蒸发结晶 干燥的沉淀A1,或固体B 500mL容量瓶、玻璃棒 5.1 AD
【解析】
分离KNO3和Ba(NO3)2两种固体混合物,可先溶于水,然后加入过量K2CO3使Ba(NO3)2转化为沉淀,过滤后沉淀加入硝酸可生成Ba(NO3)2溶液,经蒸发、结晶、干燥后可得固体Ba(NO3)2,操作②所得滤液为KNO3和K2CO3的混合物,蒸发结晶得到固体C为KNO3和K2CO3,应加入过量硝酸可得KNO3,A为不纯的BaCO3沉淀,经过洗涤干燥得到A1为纯净的BaCO3沉淀,加硝酸,蒸发得到固体B为Ba(NO3)2,以此解答该题。
(1)由以上分析可知试剂a为K2CO3溶液,试剂b为硝酸,加入试剂b,BaCO3沉淀加入硝酸可生成Ba(NO3)2溶液,反应的化学方程式为![]()
故答案为:K2CO3溶液;![]() ;
;
(2) 操作②所得滤液为KNO3和K2CO3的混合物,蒸发结晶得到固体C为KNO3和K2CO3,蒸发结晶前应加入适量稀硝酸,将过量的碳酸钾转化成硝酸钾,否则晶体不纯,所以该方案不能达到实验目的,
故答案为:应在操作②的滤液中加入过量硝酸后再蒸发结晶;
(3)固体溶解后加入过量K2CO3使Ba(NO3)2,转化为碳酸钡沉淀,过滤后沉淀加入试剂b硝酸可将碳酸钡转化成Ba(NO3)2溶液,然后经蒸发、结晶、干燥后可得固体Ba(NO3)2,若要测定原混合物中KNO3和Ba(NO3)2的质量分数,除了要准确称量混合物的质量外,至少还要获得的数据是固体B或干燥的沉淀A1的质量,依据B为Ba(NO3)2计算得到质量分数,A1为碳酸钡,结合钡元素守恒计算氯化钡质量得到,
故答案为:干燥的沉淀A1,或固体B;
(4) ①配制0.1 mol/L KNO3溶液450mL需要500mL容量瓶,配制溶液一般步骤:计算、称量、溶解、冷却、移液、洗涤、定容、摇匀等,用到的仪器:托盘天平、药匙、烧杯、玻璃棒、500mL容量瓶、胶头滴管,还缺少的玻璃仪器:500mL容量瓶、玻璃棒;
故答案为:500mL容量瓶、玻璃棒;
②用固体KNO3配制0.1 mol/L KNO3溶液450mL,应选择500mL容量瓶,实际配制500mL溶液,需要KNO3质量为:0.1mol/L×0.5L×101g/mol=5.05g;由于托盘天平的精确度为0.1g,故用天平称量的质量为5.1g,
故答案为:5.1g;
③A. 称量固体时,砝码与药品的位置放反了,即“左码右物”,会使称量药品的质量偏小, 根据c=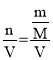 ,导致所得溶质的物质的量浓度偏小,故A符合题意;
,导致所得溶质的物质的量浓度偏小,故A符合题意;
B. 使用有少量蒸馏水的容量瓶,定容时还要加水,故对浓度无影响,故B不符合题意;
C. 定容时俯视刻度线观察液面会使v偏小,根据c=![]() ,故浓度偏大,故C不符合题意;
,故浓度偏大,故C不符合题意;
D. 洗涤和转移时有液体外溅会使n减小,根据c=![]() ,故浓度偏小,故D符合题意;
,故浓度偏小,故D符合题意;
故答案为AD。