题目内容
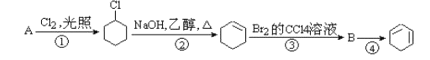
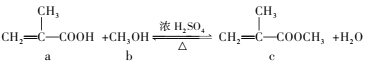
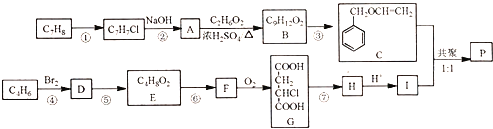
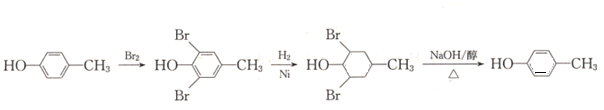
【题目】高分子聚合物P的合成路线如下:
(1)写出反应所需试剂与条件。反应①________;反应⑦________。
(2)写出反应类型。反应③________;反应⑥________。
(3)写出结构简式。E________________;P________________。
(4)设计反应⑥⑦的目的是______________。
(5)写出符合下列要求的G的同分异构体的结构简式(不考虑立体结构)。_______________
Ⅰ.能发生银镜反应
Ⅱ.只含两种化学环境不同的氢原子
Ⅲ.不含-O-O-结构
(6)写出用A的一种同分异构体为原料合成![]() 的合成路线(无机原料任选).________(合成路线的常用表示方法为:A
的合成路线(无机原料任选).________(合成路线的常用表示方法为:A![]() B...
B... ![]() 目标产物)
目标产物)
【答案】氯气、光照 氢氧化钠醇溶液、加热 消去反应 加成反应 HOCH2CH=CHCH2OH 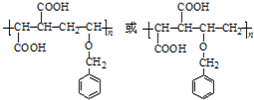 保护碳碳双键,防止被氧化
保护碳碳双键,防止被氧化 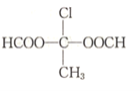
【解析】
通过逆推法原理,从C为突破,B脱去一分子水生成C,故B为C6H5-CH2OCH2CH2OH,A为苯甲醇,反应①是甲苯在高温或光照环境下发生取代反应,生成氯甲苯,在氢氧化钠水溶液发生水解反应,生成苯甲醇;通过G结构和前面的反应条件可知,C4H6为1,3-丁二烯,与溴单质反应发生1,4加成生成1,4-二溴-2-丁烯,再与氢氧化钠水溶液反应发生取代反应生成E,结构简式为HOCH2CH=CHCH2OH,E与氯化氢发生加成反应生成F,结构简式为HOCH2CH2CHClCH2OH,F被强氧化剂氧化为G,G与氢氧化钠醇溶液发生消去反应生成H,结构简式为NaOOCCH=CHCOONa,然后酸化为I,结构简式为HOOCCH=CHCOOH,C与I发生1:1共聚生成P,P为 。
。
(1)A为苯甲醇,C7H8为甲苯,在光照条件下,甲基与氯气反应发生取代反应;G和氢氧化钠醇溶液加热发生消去反应生成H;
(2)E为HOCH2CH=CHCH2OH,E与氯化氢发生加成反应生成F;B脱去1分子水生成C,即反应为消去反应;
(3)1,4-二溴-2-丁烯和氢氧化钠水溶液发生取代反应生成E,E为HOCH2CH=CHCH2OH;C与I发生1:1共聚生成P,P为 ;
;
(4)强氧化剂能氧化碳碳双键,F氧化为G,只氧化了羟基而不改变碳碳双键结构,即设计反应的目的是保护碳碳双键,防止被氧化;
(5) G为2-氯-1,4-丁二醛,Ⅰ.能发生银镜反应,说明含有醛基;Ⅱ.只含两种化学环境不同的氢原子,说明为对称结构;综合Ⅲ可知,同分异构体应含有2个甲酸酯且对称,可能的结构为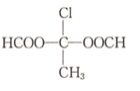 ;
;
(6)A 为苯甲醇,根据逆推法原理,合成![]() 的A的同分异构体为对甲苯酚,可能的途径为
的A的同分异构体为对甲苯酚,可能的途径为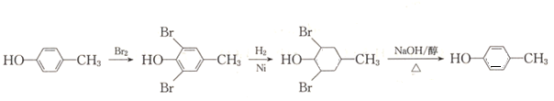 。
。

【题目】(1)“一氧化碳变换”是合成氨原料气生产中的重要环节,其反应方程式为:CO(g)+H2O(g)![]() CO2(g)+H2(g)。将不同量的CO(g)和H2O(g)分别通入体积为2L的恒容密闭容器中进行反应,得到如下三组数据:
CO2(g)+H2(g)。将不同量的CO(g)和H2O(g)分别通入体积为2L的恒容密闭容器中进行反应,得到如下三组数据:
实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
CO | H2O | CO2 | CO | |||
1 | 650 | 4 | 2 | 1.6 | 2.4 | 5 |
2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
3 | 650 | 2 | 1 | A | B | t |
①实验1中从反应开始到达到平衡,以H2的浓度变化表示的反应速率为_________
②A=_________
③平衡常数:K(900℃)_________K(650℃)(填“>”、“<”或“=”).
(2)温度是一氧化碳变换中最重要的工艺条件,实际生产过程中将温度控制在400℃左右,可能的原因是__________。
(3)下列描述中能说明上述反应已达平衡的是___________________
a.v正(CO)=v逆(H2) b.气体的密度不随时间而变化
c.H2和CO2的比例保持不变 d.气体的压强不再发生变化
(4)C、H、O、N元素中,写出两两组合(不能重复)形成的非极性分子的电子式_________,极性分子的电子式_________。这四种元素形成的化合物_________(填“一定是”、“一定不是”、“不一定是”)离子化合物。