题目内容
【题目】某无色稀溶液X中,可能含有下表所列离子中的某几种。
阴离子 | CO |
阳离子 | Al3+、Fe3+、Mg2+、NH |
现取该溶液适量,向其中加入某试剂Y,产生沉淀的物质的量(n)与加入试剂Y的体积(V)的关系如图所示。
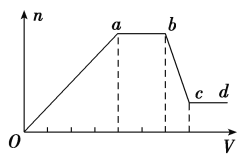
(1)若Y是盐酸,则X中一定含有的离子是_____________,Oa段发生反应的离子方程式为________________,ab段发生反应的离子方程式为______________,bc段发生反应的离子方程式为_________________________。
(2)若Y是NaOH溶液,则X中一定含有的离子是______________,则Oa段转化为沉淀的离子是_______________________,
ab段发生反应的离子方程式为_________________________,
bc段发生反应的离子方程式为_________________________。
【答案】(1)CO![]() 、SiO
、SiO![]() 、AlO
、AlO![]() 、Na+
、Na+
SiO![]() +2H+===H2SiO3↓、
+2H+===H2SiO3↓、
AlO![]() +H++H2O===Al(OH)3↓
+H++H2O===Al(OH)3↓
CO![]() +H+===HCO
+H+===HCO![]() 、HCO
、HCO![]() +H+===H2O+CO2↑
+H+===H2O+CO2↑
Al(OH)3+3H+===Al3++3H2O
(2)Al3+、Mg2+、NH![]() 、Cl- Al3+、Mg2+
、Cl- Al3+、Mg2+
NH![]() +OH-===NH3·H2O Al(OH)3+OH-===AlO
+OH-===NH3·H2O Al(OH)3+OH-===AlO![]() +2H2O
+2H2O
【解析】溶液无色说明不含Fe3+。
(1)如果Y是盐酸,向溶液中加盐酸,先生成沉淀,则溶液中含SiO![]() 、AlO
、AlO![]() 中的一种或两种;ab段时,沉淀的量不变化,即盐酸和碳酸根离子反应:CO
中的一种或两种;ab段时,沉淀的量不变化,即盐酸和碳酸根离子反应:CO![]() +H+===HCO
+H+===HCO![]() 、HCO
、HCO![]() +H+===H2O+CO2↑;bc段时沉淀的质量减少,但最终仍有沉淀存在,说明生成的沉淀既有H2SiO3又有Al(OH)3,原溶液中有SiO
+H+===H2O+CO2↑;bc段时沉淀的质量减少,但最终仍有沉淀存在,说明生成的沉淀既有H2SiO3又有Al(OH)3,原溶液中有SiO![]() 和AlO
和AlO![]() ,则一定不含Al3+、Mg2+,Oa段发生反应的离子方程式为SiO
,则一定不含Al3+、Mg2+,Oa段发生反应的离子方程式为SiO![]() +2H+===H2SiO3↓、AlO
+2H+===H2SiO3↓、AlO![]() +H++H2O===Al(OH)3↓;由于SiO
+H++H2O===Al(OH)3↓;由于SiO![]() 和AlO
和AlO![]() 均能和铵根离子发生水解相互促进反应,所以溶液中不含NH
均能和铵根离子发生水解相互促进反应,所以溶液中不含NH![]() ,则含有的阳离子是Na+。(2)若Y是氢氧化钠溶液,向溶液中加氢氧化钠溶液,先生成沉淀,即溶液中含Al3+、Mg2+中的一种或两种;ab段时,沉淀的量不变化,是氢氧化钠和铵根离子发生了反应:NH
,则含有的阳离子是Na+。(2)若Y是氢氧化钠溶液,向溶液中加氢氧化钠溶液,先生成沉淀,即溶液中含Al3+、Mg2+中的一种或两种;ab段时,沉淀的量不变化,是氢氧化钠和铵根离子发生了反应:NH![]() +OH-===NH3·H2O,即溶液中含NH
+OH-===NH3·H2O,即溶液中含NH![]() ;bc段时沉淀的质量减少,但没有完全溶解,说明溶液中有Al3+、Mg2+,则溶液中不含CO
;bc段时沉淀的质量减少,但没有完全溶解,说明溶液中有Al3+、Mg2+,则溶液中不含CO![]() 、SiO
、SiO![]() 、AlO
、AlO![]() ,由电荷守恒知溶液中一定含Cl-,bc段反应的离子方程式为Al(OH)3+OH-===AlO
,由电荷守恒知溶液中一定含Cl-,bc段反应的离子方程式为Al(OH)3+OH-===AlO![]() +2H2O。
+2H2O。

【题目】下列图象中,纵坐标为沉淀物的量,横坐标为溶液中加入反应物的物质的量,试按题意将图象中相应的数字序号填入表中的顺序为
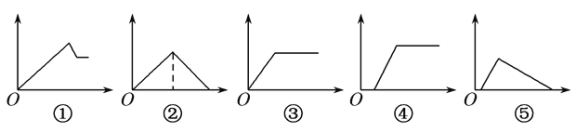
溶液 | 加入物质 | 相应序号 |
(1)氯化铝溶液 | 加入过量氨水 | |
(2)饱和澄清石灰水 | 通入过量CO2气体 | |
(3)含少量NaOH的偏铝酸钠溶液 | 通入过量CO2气体 | |
(4)含少量NaOH的偏铝酸钠溶液 | 逐滴加入稀盐酸 | |
(5)MgCl2、AlCl3的混合溶液 | 逐滴加入NaOH溶液至过量 |
A. ①③②④⑤ B. ③⑤④②①
C. ①②③④⑤ D. ③②④⑤①