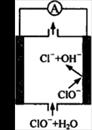
题目内容
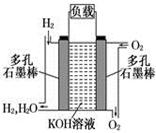
(9分)下图是某化学兴趣小组探究不同条件下化学能转变为电能的装置。
请回答下列问题:
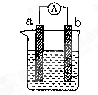
(1)当电极a为Al,电极b为Cu,电解质溶液为稀硫酸时,正极的电极反应式为: 。
(2)当电极a为Al,电极b为Mg,电解质溶液为氢氧化钠溶液时,该装置
(填“能”或“不能”)形成原电池,若不能,请说明理由;若能,请指出正、负极材料: 。当反应中收集到标准状况下224mL气体时,消耗的电极质量为 g。
(3)燃料电池的工作原理是将燃料和氧化剂(如O2)反应所产生的化学能直接转化为电能。现设计一燃料电池,以电极a为正极,电极b为负极,甲烷为燃料,采用氢氧化钠溶液为电解液;则甲烷应通入 极(填a或b,下同),电子从 极流出,电解质溶液中OH-向 极移动。
请回答下列问题:

(1)当电极a为Al,电极b为Cu,电解质溶液为稀硫酸时,正极的电极反应式为: 。
(2)当电极a为Al,电极b为Mg,电解质溶液为氢氧化钠溶液时,该装置
(填“能”或“不能”)形成原电池,若不能,请说明理由;若能,请指出正、负极材料: 。当反应中收集到标准状况下224mL气体时,消耗的电极质量为 g。
(3)燃料电池的工作原理是将燃料和氧化剂(如O2)反应所产生的化学能直接转化为电能。现设计一燃料电池,以电极a为正极,电极b为负极,甲烷为燃料,采用氢氧化钠溶液为电解液;则甲烷应通入 极(填a或b,下同),电子从 极流出,电解质溶液中OH-向 极移动。
(1)2H++2e-=H2↑;(2)能,镁(或b)为正极,铝(或a)为负极;0.18;(3)b;b;b
试题分析:(1)当电极a为Al,电极b为Cu,电解质溶液为稀硫酸时,由于活动性Al>Cu.所以Al为负极。Cu为正极。在正极的电极反应式为:2H++2e-=H2↑;(2)当电极a为Al,电极b为Mg,电解质溶液为氢氧化钠溶液时,由于Al能与NaOH溶液发生氧化还原反应,所以该装置能够形成原电池。Al为负极;Mg为正极。反应的总方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑。n(H2)=0.224L÷22.4L/mol=0.01mol,所以根据方程式中Al的质量为2/3×0.01mol×27g/mol="0.18g." (3)该电池为甲烷燃料电池,通入甲烷的电极为负极,通入氧气的电极为正极。由于电极a为正极,电极b为负极,所以b电极通入甲烷,电子从电源的负极流出,经用电器流回到正极。因此电子从负极b流出,在电解质溶液中,根据同种电荷相互排斥,异种电荷相互吸引的原则,电解质溶液中OH-向正电荷较多的负极b移动。

练习册系列答案
相关题目