题目内容
0.5mol的Y元素的离子得到6.02×1023个电子被还原成中性原子,0.4gY的氧化物恰好与100mL 0.2mol?L-1 的盐酸完全反应,Y原子核内质子数和中子数相等.写出:(1)Y的元素符号为 ,它在周期表的位置为 ;
(2)Y的氧化物与盐酸反应的离子方程式为 .
【答案】分析:6.02×1023个电子为1mol,则0.5mol的Y元素的离子得到2mol电子还原为中性原子,则离子为Y2+,利用YO+2HCl═YCl2+H2O计算Y的摩尔质量,再利用Y原子核内质子数和中子数相等来确定Y的位置,以此来解答.
解答:解:(1)6.02×1023个电子为1mol,则0.5mol的Y元素的离子得到2mol电子还原为中性原子,则离子为Y2+,
设YO的物质的量为x,
由YO+2HCl═YCl2+H2O
1 2
x 0.1L×0.2mol/L
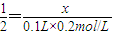 ,
,
解得x=0.01mol,
则YO的摩尔质量为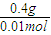 =40g/mol,
=40g/mol,
则Y的摩尔质量为40g/mol-16g/mol=24g/mol,
即Y的相对原子质量为24,又Y原子核内质子数和中子数相等,
则质子数为12,为Mg元素,位于第三周期第ⅡA族,
故答案为:Mg;第三周期第ⅡA族;
(2)化学反应为MgO+2HCl═MgCl2+H2O,MgO、H2O在离子反应中应保留化学式,
则离子反应为MgO+2H+═Mg2++H2O,故答案为:MgO+2H+═Mg2++H2O.
点评:本题考查原子结构与元素周期律,明确Y的化合价及氧化物与酸的反应是解答本题的关键,并熟悉元素的位置及元素周期律来解答,难度不大.
解答:解:(1)6.02×1023个电子为1mol,则0.5mol的Y元素的离子得到2mol电子还原为中性原子,则离子为Y2+,
设YO的物质的量为x,
由YO+2HCl═YCl2+H2O
1 2
x 0.1L×0.2mol/L
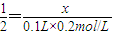 ,
,解得x=0.01mol,
则YO的摩尔质量为
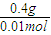 =40g/mol,
=40g/mol,则Y的摩尔质量为40g/mol-16g/mol=24g/mol,
即Y的相对原子质量为24,又Y原子核内质子数和中子数相等,
则质子数为12,为Mg元素,位于第三周期第ⅡA族,
故答案为:Mg;第三周期第ⅡA族;
(2)化学反应为MgO+2HCl═MgCl2+H2O,MgO、H2O在离子反应中应保留化学式,
则离子反应为MgO+2H+═Mg2++H2O,故答案为:MgO+2H+═Mg2++H2O.
点评:本题考查原子结构与元素周期律,明确Y的化合价及氧化物与酸的反应是解答本题的关键,并熟悉元素的位置及元素周期律来解答,难度不大.

练习册系列答案
相关题目