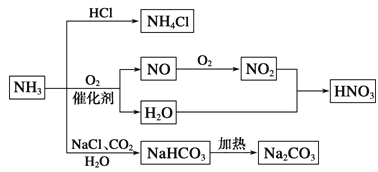
题目内容
【题目】下列元素的原子半径依次减小的是 ( )
A. Na、Mg、Al B. N、P、As C. P、Si、Al D. C、Si、P
【答案】A
【解析】A.Na、Mg、Al为同周期元素,原子半径随着原子序数的增大而减小,Na、Mg、Al的原子半径依次减小;B.N、P、As 属于同主族元素,原子半径随着电子层数增多而增大,N、P、As的原子半径依次增大;C.P、Si、Al为同周期元素, P、Si、Al的原子半径依次增大;D.C、Si是同周期元素,原子半径C<Si,Si、P属于同周期元素,原子半径Si>P,所以C、Si、P的原子半径没有一定的变化规律。故选A。

练习册系列答案
相关题目
【题目】在温度T1和T2时,分别将0.50 mol CH4和1.20 mol NO2充入体积为1 L的密闭容器中,发生如下反应:CH4(g)+2NO2(g)![]() N2(g)+CO2(g)+2H2O(g),测得n(CH4)随时间变化数据如下表:
N2(g)+CO2(g)+2H2O(g),测得n(CH4)随时间变化数据如下表:
时间/min | 0 | 10 | 20 | 40 | 50 | |
T1 | n(CH4)/mol | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
T2 | n(CH4)/mol | 0.50 | 0.30 | 0.18 | …… | 0.15 |
下列说法正确的是( )
A. T1时0~10 min NO2的平均反应速率为0.15 mol·L-1·min -1
B. T2时CH4的平衡转化率为70.0%
C. 保持其他条件不变,T1时向平衡体系中再充入0.30 mol CH4和0.80 mol H2O(g),平衡向正反应方向移动
D. 保持其他条件不变,T1时向平衡体系中再充入0.50 mol CH4和1.20 mol NO2,与原平衡相比,达新平衡时N2的浓度增大