题目内容
【题目】铝是重要的金属材料,铝土矿(主要成分是Al2O3和少量的SiO2、Fe2O3杂质)是工业上制取铝的原料。实验室模拟工业上以铝土矿为原料制铵明矾晶体的工艺流程如图所示:
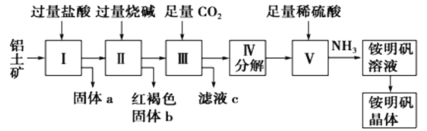
请回答下列问题:
(1)固体a的化学式为___,固体b化学式为___,Ⅲ中通入足量CO2气体发生反应的离子方程式为___。
(2)由Ⅴ制取铵明矾溶液的化学方程式为___。
(3)由I→II→III→IV都要用到的分离方法是___,由铵明矾溶液中制铵明矾晶体的操作是___,___,过滤,洗涤,干燥保存。
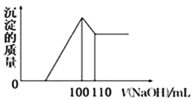
(4)向10gFe2O3、SiO2和Al2O3的混合物中,加入100mL稀硫酸,过滤后,向滤液中加入10mol/LNaOH溶液,产生沉淀的质量和加入NaOH溶液体积的关系曲线如图所示。则混合物中三氧化二铝的质量分数为___。
(5)有一种含铁、硅等元素的矿石,其主要成分的化学式为Na2Fe5(OH)2Si8O22,该物质中+2价铁与+3价铁的物质的量之比为___。将mg该矿石用足量的酸溶解后,加入过量铜粉使溶液中的铁元素全部变为Fe2+,过滤后滤液用cmol/L的KMnO4酸性溶液与Fe2+反应,用去VmL溶液。该矿石中铁元素的质量分数为___(用含m、c、V的代数式表示)。
【答案】SiO2 Fe(OH)3 AlO2-+CO2+2H2O=HCO3-+Al(OH)3↓ Al2O3+4H2SO4+2NH3=2NH4Al(SO4)2+3H2O 过滤 蒸发浓缩 冷却结晶 51% 3:2 ![]() ×100%
×100%
【解析】
铝土矿的主要成分中加盐酸后氧化铝和氧化铁溶解,二氧化硅不溶于盐酸,过滤,滤液中加过量烧碱后氯化铁转变成氢氧化铁沉淀,氯化铝转变成偏铝酸钠,过滤,在偏铝酸钠溶液中通过量的二氧化碳,产生氢氧化铝,分解得到氧化铝,加足量硫酸溶解产生硫酸铝,通氨气得到铵明矾溶液,结晶得到晶体,据此过程分析解答。
(1)铝土矿中主要成分是Al2O3和Fe2O3均可溶于盐酸形成盐,而SiO2不与盐酸反应,因此固体a为SiO2,在氯化铝和氯化铁的滤液中加足量的氢氧化钠溶液,氯化铁与碱反应产生氢氧化铁红褐色沉淀即固体b,氯化铝与氢氧化钠反应最终转变成偏铝酸钠,偏铝酸钠与二氧化碳反应产生氢氧化铝沉淀,反应为:AlO2-+CO2+2H2O=HCO3-+Al(OH)3↓,
故答案为: SiO2;Fe(OH)3;AlO2-+CO2+2H2O=HCO3-+Al(OH)3↓;
(2)V中是氧化铝加足量硫酸后再通氨气反应产生铵明矾的过程,反应为:Al2O3+4H2SO4+2NH3=2NH4Al(SO4)2+3H2O,
故答案为:Al2O3+4H2SO4+2NH3=2NH4Al(SO4)2+3H2O;
(3)由以上流程分析可知I→II→III→IV都涉及到难溶固体和溶液的分离,应采用过滤的方法;铵明矾溶液中制铵明矾晶体应该采用降温结晶的方法,先对稀溶液进行蒸发浓缩后再进行降温结晶,然后过滤后洗涤,干燥,
故答案为:过滤;蒸发浓缩;冷却结晶;
(4)三种氧化物中二氧化硅不溶于盐酸,铁铝的氧化物转变成氯化铁和氯化铝,再加碱起始阶段没有沉淀产生说明盐酸过量,氢氧化钠先中和未反应的酸,再与盐反应产生沉淀,直到沉淀量达最大值,再加碱氢氧化铝溶于氢氧化钠,而氢氧化铁不与碱反应,结合图示可知100-110mL阶段发生如下反应:![]() ,消耗氢氧化钠的物质的量为:
,消耗氢氧化钠的物质的量为:![]() ,则氢氧化铝的物质的量也为0.1mol,根据铝元素守恒可知:氧化铝的物质的量为0.05mol,则混合物中三氧化二铝的质量分数为=
,则氢氧化铝的物质的量也为0.1mol,根据铝元素守恒可知:氧化铝的物质的量为0.05mol,则混合物中三氧化二铝的质量分数为=![]() ,
,
故答案为:51%;
(5)化学式Na2Fe5(OH)2Si8O22,设1mol该物质中+2价铁为xmol,+3价铁ymol,则x+y=5,再结合化合物中正负化合价的代数和为零可得:![]() ,整理得:2x+3y=12,解得:x=3,y=2,+2价铁与+3价铁的物质的量之比为3:2;KMnO4酸性溶液与Fe2+反应,
,整理得:2x+3y=12,解得:x=3,y=2,+2价铁与+3价铁的物质的量之比为3:2;KMnO4酸性溶液与Fe2+反应,![]() ,反应消耗的高锰酸钾的物质的量为:
,反应消耗的高锰酸钾的物质的量为:![]() ,则n(Fe2+)=
,则n(Fe2+)=![]() ,该矿石中铁元素的质量分数=
,该矿石中铁元素的质量分数=![]() =
=![]() ×100%,
×100%,
故答案为:3:2;![]() ×100%。
×100%。

 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案