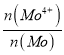题目内容
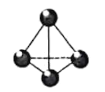
【题目】白磷(P4)的正四面体结构如图所示,能与Ba(OH)2溶液发生反应: 2P4+3Ba(OH)2 + 6H2O=3Ba(H2PO2)2 +2PH3↑。若该反应消耗白磷3.1g,则下列说法正确的是( )
A.水是还原剂,消耗水的质量为1.35g
B.产生PH3,气体560mL
C.转移0. 75 mol电子
D.反应断开了0.15 molP-P键
【答案】D
【解析】
A.根据方程式可知,水的组成元素在反应前后元素化合价没有发生变化,因此水既不是氧化剂,也不是还原剂,A错误;
B.题目未指明气体所处的外界条件,因此不能确定气体的体积大小,B错误;
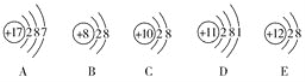
C.根据方程式可知:该反应中白磷参加反应时,有![]() 的白磷失去电子,被氧化,作还原剂、
的白磷失去电子,被氧化,作还原剂、![]() 的白磷获得电子,被还原,作氧化剂,1mol白磷反应即有(31×4)g白磷反应时,转移电子的物质的量是3e-mol,则3.1g白磷反应,转移电子的物质的量是n(e-)=
的白磷获得电子,被还原,作氧化剂,1mol白磷反应即有(31×4)g白磷反应时,转移电子的物质的量是3e-mol,则3.1g白磷反应,转移电子的物质的量是n(e-)=![]() mol=0.075mol,C错误;
mol=0.075mol,C错误;
D.根据方程式可知:每有1mol(31×4)g白磷发生反应,断裂P-P键6mol,则有3.1g白磷反应,断裂P-P键的物质的量n=![]() mol=0.15mol,D正确;
mol=0.15mol,D正确;
故合理选项是D。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
【题目】实验室中某些气体的制取、干燥及收集装置如图所示(省略夹持装置和尾气处理装置),仅用此装置和表中提供的物质完成相关实验,合理的是( )
选项 | a中物质 | b中物质 | c中干燥剂 | d收集气体 |
|
A | 浓硫酸 | 亚硫酸钠 | 无水氯化钙 | SO2 | |
B | 稀硫酸 | 大理石 | 无水氯化钙 | CO2 | |
C | 稀硝酸 | 铜片 | 碱石灰 | NO | |
D | 浓氨水 | 熟石灰 | 碱石灰 | NH3 |
A.AB.BC.CD.D