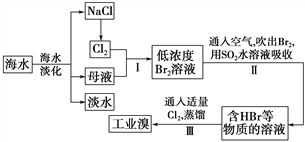
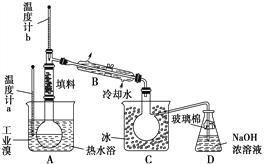
题目内容
【题目】生产生活中的化学电源、金属冶炼、环境污染等都与氧化还原反应息息相关,研究氧化还原反应,对人类进步和社会发展都具有极其重要的意义。
(1)已知下列反应在一定条件下可以发生:H2O2+2Fe2++2H+=2Fe3++2H2O;H2O2+2Fe3+= 2Fe2++2H+ +O2↑
①通过观察以上两个反应,对其中Fe2+的认识是 __________________。
②I2和Fe2+一样也能与H2O2发生上述类似反应,类比上述反应,在下面空格上填入合适的化学方程式:H2O2+I2= 2HIO;___________。总的化学方程式为_____________________________。
(2)2017年4月1日,中共中央、国务院印发通知,决定设立河北雄安新区。据报道周边污水渗坑给雄安新区的水环境带来隐患,目前采用多种方法对污水进行处理,改善水资源状况。
①碱性环境下,Cl2可将水中残存的CN-转化为两种无毒的气体,则该反应生成两种无毒气体的物质的量之比为_________________。
②酸性环境下,向含重铬酸根(Cr2O72-)的废水中加入FeSO4溶液,然后调节溶液pH,使生成的Cr3+转化为Cr(OH)3,写出第一步反应对应的离子方程式________________________________。
【答案】 其为过氧化氢分解的催化剂 2HIO+H2O2=I2+2H2O+O2↑ 2H2O2![]() 2H2O+O2↑ 2:1或1:2 Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O
2H2O+O2↑ 2:1或1:2 Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O
【解析】(1)已知下列反应在一定条件下可以发生:H2O2+2Fe2++2H+=2Fe3++2H2O;H2O2+2Fe3+= 2Fe2++2H+ +O2↑,①通过观察以上两个反应,将两方程式相加,得2H2O2=2H2O+O2↑,对其中Fe2+的认识是反应的催化剂;②用总反应2H2O2=2H2O+O2↑减去H2O2+I2= 2HIO得2HIO+H2O2=I2+2H2O+O2↑ ;总的化学方程式为2H2O2![]() 2H2O+O2↑ ;(2)2CN-+8OH-+5Cl2=2CO2+N2+10Cl-+4H2O,生成两种无毒气体CO2和N2的物质的量之比为2:1;在酸性环境下,酸性环境下能够氧化二价铁离子生成三价铁离子,本身被还原为三价铬离子,反应的离子方程式为Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O。
2H2O+O2↑ ;(2)2CN-+8OH-+5Cl2=2CO2+N2+10Cl-+4H2O,生成两种无毒气体CO2和N2的物质的量之比为2:1;在酸性环境下,酸性环境下能够氧化二价铁离子生成三价铁离子,本身被还原为三价铬离子,反应的离子方程式为Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O。

 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案【题目】将等物质的量的N2、H2气体充入某密闭容器中,在一定条件下发生反应并达到平衡:N2(g)+3H2(g) ![]() 2NH3(g) ΔH<0。当改变某个条件并维持新条件直至新的平衡时,下表中关于新平衡与原平衡的比较正确的是( )
2NH3(g) ΔH<0。当改变某个条件并维持新条件直至新的平衡时,下表中关于新平衡与原平衡的比较正确的是( )
选项 | 改变条件 | 新平衡与原平衡比较 |
A | 增大压强 | N2的浓度一定变小 |
B | 升高温度 | N2的转化率变小 |
C | 充入一定量H2 | H2的转化率不变,N2的转化率变大 |
D | 使用适当催化剂 | NH3的体积分数增大 |
A. A B. B C. C D. D