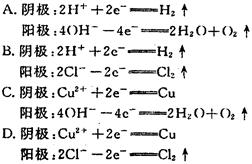题目内容
(14分)(2011·温州高二检测)在25 ℃时,用石墨电极电解2.0 L 0.5 mol·L-1 CuSO4溶液。5 min后,在一个石墨电极上有6.4 g Cu生成。试回答下列问题:
(1)发生氧化反应的是________极,电极反应式为____________________________
________________________________________________________________________。
(2)若电解后溶液的体积不变,则电解后溶液的pH为________。
(3)若将溶液恢复到与电解前一样,则需加入________mol的________。
(4)若用等质量的两块铜片代替石墨作电极,电解后两铜片的质量相差________g,电解液的pH________。(填“变小”、“变大”或“不变”)
(1)发生氧化反应的是________极,电极反应式为____________________________
________________________________________________________________________。
(2)若电解后溶液的体积不变,则电解后溶液的pH为________。
(3)若将溶液恢复到与电解前一样,则需加入________mol的________。
(4)若用等质量的两块铜片代替石墨作电极,电解后两铜片的质量相差________g,电解液的pH________。(填“变小”、“变大”或“不变”)
(1)阳 4OH--4e-===2H2O+O2↑
(2)1 (3)0.1 CuO (4)12.8 不变
(2)1 (3)0.1 CuO (4)12.8 不变
(1)n(CuSO4)=2.0 L×0.5 mol/L=1.0 mol,而在阴极析出的Cu为=0.1 mol,故CuSO4未完全电解,阳极发生氧化反应,电极反应为4OH--4e-===2H2O+O2↑。
(2)总反应为:
2CuSO4+2H2O2Cu + O2↑ + 2H2SO4
2 2 2 1 2
0.1 mol 0.1 mol 0.1 mol 0.05 mol 0.1 mol
所以电解后c(H+)==0.1 mol/L,
故pH=-lg 0.1=1。
(3)电解后生成的0.1 mol Cu和0.05 mol O2脱离该体系,即相当于0.1 mol CuO,因此若将溶液复原,则应加入0.1 mol CuO。
(4)此时成为电镀池,阳极Cu-2e-===Cu2+,阴极:Cu2++2e-===Cu,因此若阴极上析出6.4 g铜,则阳极溶解6.4 g铜,电解后两铜片质量差为6.4 g+6.4 g=12.8 g,而电解液的pH不变。
(2)总反应为:
2CuSO4+2H2O2Cu + O2↑ + 2H2SO4
2 2 2 1 2
0.1 mol 0.1 mol 0.1 mol 0.05 mol 0.1 mol
所以电解后c(H+)==0.1 mol/L,
故pH=-lg 0.1=1。
(3)电解后生成的0.1 mol Cu和0.05 mol O2脱离该体系,即相当于0.1 mol CuO,因此若将溶液复原,则应加入0.1 mol CuO。
(4)此时成为电镀池,阳极Cu-2e-===Cu2+,阴极:Cu2++2e-===Cu,因此若阴极上析出6.4 g铜,则阳极溶解6.4 g铜,电解后两铜片质量差为6.4 g+6.4 g=12.8 g,而电解液的pH不变。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
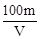
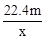
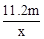
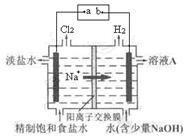
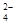 ),在任何情况下,阴、阳两极不可能同时发生的反应是 ( )
),在任何情况下,阴、阳两极不可能同时发生的反应是 ( )