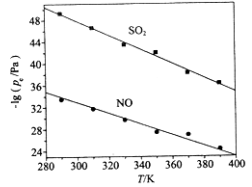
题目内容
【题目】下列有关物质的性质与用途具有对应关系的是( )
A.NH3极易溶于水,可用于工业制冷剂
B.HNO3具有酸性,可用于制备硝酸盐原料
C.NH4 NO3易溶于水,可用于制造高温材料
D.N2难溶于水,可用于合成氨原料
【答案】B
【解析】解:A.液氨汽化时要吸收大量的热,可用作制冷剂,故A错误; B.酸与碱、碱性氧化物等反应生成盐,所以HNO3具有酸性,可用于制备硝酸盐原料,故B正确;
C.NH4NO3受热易分解,不能用于制造高温材料,制造高温材料要用高熔点的物质,与物质的溶解性无关,故C错误;
D.氮气与氢气反应生成氨气,可用于合成氨原料,与氮气的物理性质无关,故D错误.
故选B.

【题目】某化学兴趣小组发现实验室有多件表面呈灰绿色的金属制品, 经了解其来源并查阅相关资料(如下表),初步确认为铜制品。
紫铜 | 青铜 | 铜绿 | |
主要成分 | 纯铜 | 铜锡合金 | Cu2(OH)2CO3 |
性质与用途 | 紫红色, 质软,导电性能良好;主要用作电线电缆。 | 多呈灰绿色, 熔点低、硬度大、 可塑性强;可铸造成各种器具。 | 不溶于水的灰绿色粉末,溶于酸, 加热易分解;可作颜料、杀虫剂。 |
针对铜制品表面的灰绿色物质究竟是什么,同学们提出了多种猜想并展开实验探究。
【猜想假设】
(1)小吴同学认为可能是纯铜制品表面涂上了灰绿色的油漆;
小周同学认为可能是青铜(铜锡合金),因为常见的青铜是灰绿色的;
小黄同学认为是纯铜制品,只是表面长出了铜绿[ Cu2(OH)2CO3 ];
除上述猜想外,其他合理的猜想是____________________(只写一个)。
【实验验证】三位同学为了验证各自上述的猜想,进行了以下探究:
(2)小吴刮下部分灰绿色物质放入燃烧匙中进行灼烧,发现该物质不能燃烧,证明灰绿色物质不是油漆。 其判断依据是________________________。
(3)小周刮下足量的灰绿色物质投入盐酸溶液中,观察到有气体产生,实验表明该气体不能燃烧。将表面刮净后的铜制品也投入盐酸中,并无气体产生。由此证明该铜制品不是青铜,理由是__________________。
(4)根据上述实验,小黄认为灰绿色物质可能是铜绿[ Cu2(OH)2CO3 ]。于是按图5所示装置进行实验。
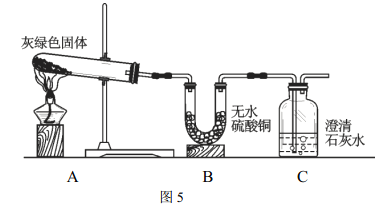
实验证明小黄的猜测是正确的,因为在A中观察到灰绿色物质变黑,B中观察到了___________的现象, C中观察到了_____________的现象。B中所发生反应的化学方程式为:__________________。
如果将实验装置中的B和C进行调换,将无法得出灰绿色物质是铜绿的结论,原因是______________。
【实验拓展】
(5)小黄同学还从网上找到了利用氨水擦拭去除铜绿的方法,其原理是氨水与碱式碳酸铜反应生成铜氨络离子[Cu(NH3)42+],其离子方程式可表示为:___________________________。