题目内容
NH4HCO3是一种离子化合物,下列关于该物质的叙述错误的是( )
| A、所含四种元素的原子半径由小到大的顺序为:H<O<N<C | ||
| B、同周期的三种元素的得电子能力由大到小的顺序为:O>N>C | ||
| C、除去NaCl固体中混有少量的NH4HCO3固体可以采用加热的方法 | ||
D、其与足量氢氧化钠溶液共热的离子方程式为:NH4++OH-
|
分析:A.C、N、O位于相同周期,同周期元素从左到右,原子半径逐渐减小;
B.同周期元素从左到右元素的非金属性逐渐增强;
C.碳酸氢铵加热易分解;
D.与足量氢氧化钠溶液共热生成氨气、碳酸钠和水.
B.同周期元素从左到右元素的非金属性逐渐增强;
C.碳酸氢铵加热易分解;
D.与足量氢氧化钠溶液共热生成氨气、碳酸钠和水.
解答:解:A.C、N、O位于相同周期,同周期元素从左到右,原子半径逐渐减小,则半径由小到大的顺序为:H<O<N<C,故A正确;
B.同周期元素从左到右元素的非金属性逐渐增强,则得电子能力由大到小的顺序为:O>N>C,故B正确;
C.碳酸氢铵加热易分解,生产环氨气、二氧化碳和水,可用加热的方法除杂,故C正确;
D.与足量氢氧化钠溶液共热生成氨气、碳酸钠和水,反应的离子方程式为HCO3-+NH4++2OH-
NH3↑+CO32-+2H2O,故D错误.
故选D.
B.同周期元素从左到右元素的非金属性逐渐增强,则得电子能力由大到小的顺序为:O>N>C,故B正确;
C.碳酸氢铵加热易分解,生产环氨气、二氧化碳和水,可用加热的方法除杂,故C正确;
D.与足量氢氧化钠溶液共热生成氨气、碳酸钠和水,反应的离子方程式为HCO3-+NH4++2OH-
| △ |
故选D.
点评:本题考查较为综合,涉及元素周期律以及物质的分离、提纯等知识,综合考查学生的分析能力,注意相关基础知识的积累,难度中等.

练习册系列答案
 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案
相关题目
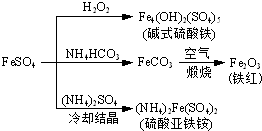 (2013?江苏三模)硫酸亚铁是一种重要的化工原料,可以制备一系列物质(如图所示).下列说法错误的是( )
(2013?江苏三模)硫酸亚铁是一种重要的化工原料,可以制备一系列物质(如图所示).下列说法错误的是( )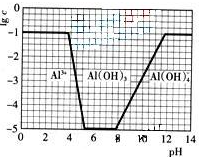 (2009?广东)超细氧化铝是一种重要的功能陶瓷原料.
(2009?广东)超细氧化铝是一种重要的功能陶瓷原料. Al2O3+3H2O↑+2CO2↑+2NH3↑
Al2O3+3H2O↑+2CO2↑+2NH3↑
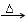 NH3↑+H2O
NH3↑+H2O