题目内容
五种短周期元素A、B、C、D、E的原子序数依次增大.A、B、C三种元素原子核外电子层数之和是5.A、B两元素原子最外层电子数之和等于C元素原子最外层电子数;B元素原子最外层上的电子数是其电子层数的2倍,A和C可以形成化合物CA3;B与D的原子序数之比为3:4;E元素原子最外层电子数比次外层电子数少1.请回答:
(1)由A、B两种元素组成的分子有多种,其中一种分子含10个电子,写出其电子式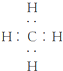
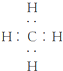 .
.
(2)化合物甲由A、B、C、D四种元素组成,既可以与盐酸反应又可以与NaOH溶液反应,且甲为无机盐,其化学式为
(3)由A、C、E三种元素组成的化合物C2A6E2是一种重要的化工原料,属于离子化合物,易溶于水,溶液呈酸性,水解原理与NH4Cl类似.写出该化合物第一步水解的离子反应方程式
(4)胶态磁流体在医学上有重要的用途,而纳米级Fe3O4是磁流体中的重要粒子,其制备过程可简单表示如下:
①将化合物CA3通入等物质的量的FeSO4、Fe2(SO4)3的混合溶液中,生成两种碱,写出该反应过程中的总离子方程式
②上述反应生成的两种碱继续作用得到Fe3O4,该反应的化学方程式为
(1)由A、B两种元素组成的分子有多种,其中一种分子含10个电子,写出其电子式
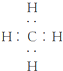
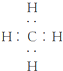
(2)化合物甲由A、B、C、D四种元素组成,既可以与盐酸反应又可以与NaOH溶液反应,且甲为无机盐,其化学式为
NH4HCO3或(NH4)2CO3
NH4HCO3或(NH4)2CO3
.(3)由A、C、E三种元素组成的化合物C2A6E2是一种重要的化工原料,属于离子化合物,易溶于水,溶液呈酸性,水解原理与NH4Cl类似.写出该化合物第一步水解的离子反应方程式
N2H62++H2O?[N2H5?H2O]++H+
N2H62++H2O?[N2H5?H2O]++H+
.(4)胶态磁流体在医学上有重要的用途,而纳米级Fe3O4是磁流体中的重要粒子,其制备过程可简单表示如下:
①将化合物CA3通入等物质的量的FeSO4、Fe2(SO4)3的混合溶液中,生成两种碱,写出该反应过程中的总离子方程式
Fe2++2Fe3++8NH3+8H2O═Fe(OH)2↓+2Fe(OH)3↓+8NH4+
Fe2++2Fe3++8NH3+8H2O═Fe(OH)2↓+2Fe(OH)3↓+8NH4+
.②上述反应生成的两种碱继续作用得到Fe3O4,该反应的化学方程式为
Fe(OH)2+2Fe(OH)3═Fe3O4+4H2O
Fe(OH)2+2Fe(OH)3═Fe3O4+4H2O
.分析:五种短周期元素A、B、C、D、E的原子序数依次增大.B元素原子最外层上的电子数是其电子层数的2倍,则B原子有2个电子层,最外层电子数为4,则B为碳元素;A、B、C三种元素原子核外电子层数之和是5,结合原子序数可知,A处于第一周期,则A为氢元素,C处于第二周期,A、B两元素原子最外层电子数之和等于C元素原子最外层电子数,则C原子最外层电子数为1+4=5,故C为氮元素,A和C可以形成化合物NH3;B与D的原子序数之比为3:4,则D的原子序数为8,故D为氧元素;E元素原子最外层电子数比次外层电子数少1,原子序数大于O元素,处于第三周期,则E最外层电子数为7,为Cl元素,据此解答.
解答:解:五种短周期元素A、B、C、D、E的原子序数依次增大.B元素原子最外层上的电子数是其电子层数的2倍,则B原子有2个电子层,最外层电子数为4,则B为碳元素;A、B、C三种元素原子核外电子层数之和是5,结合原子序数可知,A处于第一周期,则A为氢元素,C处于第二周期,A、B两元素原子最外层电子数之和等于C元素原子最外层电子数,则C原子最外层电子数为1+4=5,故C为氮元素,A和C可以形成化合物NH3;B与D的原子序数之比为3:4,则D的原子序数为8,故D为氧元素;E元素原子最外层电子数比次外层电子数少1,原子序数大于O元素,处于第三周期,则E最外层电子数为7,为Cl元素,
(1)由H、C两种元素组成的含有10个电子分子为CH4,其电子式为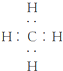 ,
,
故答案为: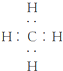 ;
;
(2)由H、C、N、O四种元素组成既可以与盐酸反应又可以与NaOH溶液反应的无机盐为NH4HCO3或(NH4)2CO3,
故答案为:NH4HCO3或(NH4)2CO3;
(3)NH4+水解为NH4++H2O?NH3?H2O+H+,类比书写N2H62+的水解方程式为N2H62++H2O?[N2H5?H2O]++H+,
故答案为:N2H62++H2O?[N2H5?H2O]++H+;
(4)①NH3的水溶液显碱性,可以将Fe2+、Fe3+转化成Fe(OH)2和Fe(OH)3沉淀,反应总离子方程式为:Fe2++2Fe3++8NH3+8H2O═Fe(OH)2↓+2Fe(OH)3↓+8NH4+,
故答案为:Fe2++2Fe3++8NH3+8H2O═Fe(OH)2↓+2Fe(OH)3↓+8NH4+;
②由题意知,两种沉淀可生成Fe3O4,由元素守恒可得产物还有H2O,反应方程式为:Fe(OH)2+2Fe(OH)3═Fe3O4+4H2O,
故答案为:Fe(OH)2+2Fe(OH)3═Fe3O4+4H2O.
(1)由H、C两种元素组成的含有10个电子分子为CH4,其电子式为
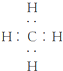 ,
,故答案为:
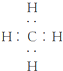 ;
;(2)由H、C、N、O四种元素组成既可以与盐酸反应又可以与NaOH溶液反应的无机盐为NH4HCO3或(NH4)2CO3,
故答案为:NH4HCO3或(NH4)2CO3;
(3)NH4+水解为NH4++H2O?NH3?H2O+H+,类比书写N2H62+的水解方程式为N2H62++H2O?[N2H5?H2O]++H+,
故答案为:N2H62++H2O?[N2H5?H2O]++H+;
(4)①NH3的水溶液显碱性,可以将Fe2+、Fe3+转化成Fe(OH)2和Fe(OH)3沉淀,反应总离子方程式为:Fe2++2Fe3++8NH3+8H2O═Fe(OH)2↓+2Fe(OH)3↓+8NH4+,
故答案为:Fe2++2Fe3++8NH3+8H2O═Fe(OH)2↓+2Fe(OH)3↓+8NH4+;
②由题意知,两种沉淀可生成Fe3O4,由元素守恒可得产物还有H2O,反应方程式为:Fe(OH)2+2Fe(OH)3═Fe3O4+4H2O,
故答案为:Fe(OH)2+2Fe(OH)3═Fe3O4+4H2O.
点评:本题考查结构性质位置关系应用,侧重对化学用语的考查,推断元素是解题关键,难度不大,注意基础知识的理解掌握.

练习册系列答案
相关题目

 下表中列出五种短周期元素A、B、C、D、E的信息,请推断后作答:
下表中列出五种短周期元素A、B、C、D、E的信息,请推断后作答:

 NH3?H2O+H+
NH3?H2O+H+