题目内容
14.室温下,在一个容积为1L的密闭容器中,充入1molN2和3molH2,发生如下反应:N2+3H2?2NH3,5min后到达平衡,平衡后混合气体的压强为起始压强的3/4,此时放出的热量为42KJ,则:(1)平衡时N2的物质的量为0.5mol
(2)5min内用H2表示的反应速率为0.3mol/(L.min)
(3)若向该1L密闭容器中再充入1molN2,则H2的转化率变大(填变大、变小或不变)
(4)写出N2和H2反应生成NH3的热化学反应方程式:N2(g)+3H2(g)=2NH3(g)△H=-84KJ/mol
(5)写出该反应的平衡常数的表达式:K=$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2})•c({H}_{2})}$.
分析 设达平衡时N2的转化量为xmol,根据三段式可知:
N2 +3H2 ?2NH3
初始(mol) 1 3 0
△n(mol) x 3x 2x
平衡(mol) (1-x) (3-3x) 2x
平衡后混合气体的压强为起始压强的3/4,可解得x.
然后根据此时放出的热量为42KJ,能求出反应热.
(1)根据三段式可解得;
(2)根据反应速率v=$\frac{\frac{△c}{V}}{△t}$来计算;
(3)根据转化率=$\frac{转化了的}{原来的}×100%$来分析计算;
(4)根据此时放出的热量为42KJ,能求出反应的反应热,然后根据热化学方程式的书写方法来完成;
(5)化学平衡常数K=$\frac{生成物的平衡浓度的幂之积}{反应物平衡浓度的幂之积}$.
解答 解:设达平衡时N2的转化量为xmol,根据三段式可知:
N2 +3H2 ?2NH3
初始(mol) 1 3 0
△n(mol) x 3x 2x
平衡(mol) (1-x) (3-3x) 2x
平衡后混合气体的压强为起始压强的3/4,有:$\frac{(1-x)+(3-3x)+2x}{4}$=$\frac{3}{4}$
解得x=0.5mol.
由于当生成0.5mol氮气放出的热量为42KJ,故当反应掉1mol氮气时,放出的热量为84KJ,即反应热△H=-84KJ/mol.
(1)根据三段式可解得平衡时氮气的物质的量n=1mol-0.5mol=0.5mol,故答案为:0.5;
(2)5min内用H2表示的反应速率为V(H2)=$\frac{\frac{△c}{V}}{△t}$=$\frac{\frac{1.5mol}{1L}}{5min}$=0.3mol/(L•min),故答案为:0.3;
(3)向该1L密闭容器中再充入1molN2,则平衡右移,消耗掉的氢气的量变多,根据转化率=$\frac{转化了的}{原来的}×100%$可知,氢气的转化率变大,故答案为:变大;
(4)由于当生成0.5mol氮气放出的热量为42KJ,故当反应掉1mol氮气时,放出的热量为84KJ,即反应热△H=-84KJ/mol,N2(g)+3H2(g)=2NH3(g)△H=-84KJ/mol,故答案为:N2(g)+3H2(g)=2NH3(g)△H=-84KJ/mol;
(5)根据化学平衡常数K=$\frac{生成物的平衡浓度的幂之积}{反应物平衡浓度的幂之积}$可知,该反应的平衡常数的表达式K=$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2})•c({H}_{2})}$,故答案为:K=$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2})•c({H}_{2})}$.
点评 本题考查了化学平衡三段式计算应用,主要是反应速率、转化率计算分析,注意气体压强之比等于气体物质的量之比,题目较简单.

 名校课堂系列答案
名校课堂系列答案| A. | 1mol任何物质都含有约6.02×1023个原子 | |
| B. | 0.012kg 12C约含有6.02×1023个碳原子 | |
| C. | 使用物质的量时,应指明粒子的种类 | |
| D. | 1mol H2的质量是2g |
| A. | 10g 甲烷所含有的分子数目为NA | |
| B. | 4g 氦气所含有的原子数目为2NA | |
| C. | 1mol 铝原子含有的电子数目为13NA | |
| D. | 电解水若产生2g 氢气,则产生的氧气分子数目为NA |
| A. | 将0.1mol HCl充分溶解在1L水中 | |
| B. | 将60g质量分数为10%的醋酸与940g水混合 | |
| C. | 将3.1g氧化钠溶于水并配成1L溶液 | |
| D. | 将16g胆矾溶于水中配成1L溶液 |
| A. | 苯和四氯化碳 | B. | 乙酸乙酯和乙醇 | C. | 乙醇和乙酸 | D. | 苯和溴苯 |
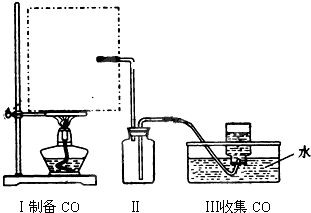
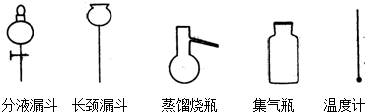
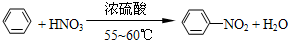 .
.
