题目内容
盖斯定律认为:不管化学过程是一步或分为数步完成,这个过程的热效应是相同的。
已知:H2O(g)= H2O(l) △H1 =-Q1 kJ·mol-1(Q1>0)
C2H5OH(g)= C2H5OH(l) △H2 =-Q2 kJ·mol-1(Q2>0)
C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(g) △H3 = -Q3 kJ·mol-1(Q3>0)若使23g液态乙醇完全燃烧,最后恢复到室温,则放出的热量为(kJ)
| A.Q1+ Q2+Q3 | B.0.5(Q1+Q2+Q3 ) |
| C.0.5 Q1-1.5 Q2+0.5Q3 | D.1.5 Q1-0.5 Q2+0.5Q3 |
D
解析试题分析:三个已知方程式为H2O(g)=H2O(l)△H1=-Q1kJ?mol-1 (1)
C2H5OH(g)=C2H5OH(l)△H2=-Q2kJ?mol-1 (2)
C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(g)△H3=-Q3kJ?mol-1(3)
乙醇燃烧生成液态水时的化学方程式为C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l)△H
利用盖斯定律求得目标方程式=3(1)-(2)+(3),
即△H=3△H1-△H2+△H3=-(3Q1-Q2+Q3),
23克乙醇的物质的量为23g/46g/mol=0.5mol,
故放出的热量为0.5×(3Q1-Q2+Q3), 故选D.
考点:盖斯定律的利用

 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案关于化学反应与能量的说法正确的是
| A.燃烧属于放热反应 | B.中和反应是吸热反应 |
| C.形成化学键时吸收能量 | D.反应物总能量与生成物总能量一定相等 |
已知C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(g) ΔH1=-a kJ/mol
C2H5OH(g)=C2H5OH(l) ΔH2=-b kJ/mol
H2O(g)=H2O(l) ΔH3=-c kJ/mol
若使92 g酒精液体完全燃烧,最后恢复到室温,则放出的热量(单位kJ)为( )
| A.4a+4b+4c | B.2a-2b+6c |
| C.2a-2b+2c | D.2a-6b+2c |
下列说法正确的是 ( )
| A.任何酸与碱发生中和反应生成1 mol H2O的过程中,能量变化均相同 |
| B.同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的ΔH相同 |
| C.已知:①2H2(g)+O2(g)=2H2O(g) ΔH=-a kJ·mol-1,②2H2(g)+O2(g)=2H2O(l) ΔH=-b kJ·mol-1,则a>b |
| D.已知:①C(s,石墨)+O2(g)=CO2(g) ΔH=-393.5 kJ·mol-1,②C(s,金刚石)+O2(g)=CO2(g) ΔH=-395.0 kJ·mol-1,则C(s,石墨)=C(s,金刚石) ΔH=+1.5 kJ·mol-1 |
工业生产水煤气的反应为:C(s)+H2O(g)=CO(g)+H2(g) ΔH=+131.4 kJ·mol-1,下列判断正确的是 ( )。
| A.反应物能量总和大于生成物能量总和 |
| B.CO(g)+H2(g)=C(s)+H2O(l)ΔH=-131.4 kJ·mol-1 |
| C.水煤气反应中生成1 mol H2(g)吸收131.4 kJ热量 |
| D.水煤气反应中生成1体积CO(g)吸收131.4 kJ热量 |
某可逆反应过程能量变化如图所示,下列说法中正确的是 ( )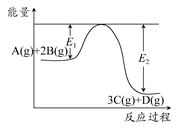
A.该反应热化学方程式为A(g)+2B(g)  3C(g)+D(g) ΔH>0 3C(g)+D(g) ΔH>0 |
| B.其他条件不变,升高温度,A的转化率增大 |
| C.其他条件不变,增大压强,释放热量减少,平衡常数K减小 |
| D.其他条件不变,加催化剂,反应速率增大,E1和E2均减小,ΔH不变 |
为保护环境并缓解能源危机,专家提出利用太阳能促使燃烧循环使用的构想,转化关系如图所示。
已知: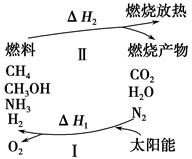
(1)过程Ⅰ可用如下反应表示:①2CO2 2CO+O2
2CO+O2
②2H2O(g)  2H2+O2
2H2+O2
③2N2+6H2O 4NH3+3O2
4NH3+3O2
④2CO2+4H2O 2CH3OH+3O2
2CH3OH+3O2
⑤2CO+4H2O ________+3O2。
________+3O2。
(2)25 ℃时,a g CH4完全燃烧释放出b kJ热量。下列说法不正确的是( )。
| A.过程Ⅰ是将太阳能转化成化学能 |
| B.反应⑤的另一种产物为CH4 |
| C.ΔH1=-ΔH2 |
| D.表示甲烷燃烧热的热化学反应方程式为CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=-16b kJ·mol-1 |
下列关于能量转换的认识中,不正确的是( )。
| A.电解水生成氢气和氧气时,电能转化为化学能 |
| B.绿色植物进行光合作用时,太阳能转化为化学能 |
| C.煤燃烧时,化学能主要转化为热能 |
| D.白炽灯工作时,电能全部转化为光能 |
已知乙炔与苯蒸气完全燃烧的热化学方程式如下所示:
①2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l)
ΔH=-2 600 kJ·mol-1
②2C6H6(g)+15O2(g)=12CO2(g)+6H2O(l)
ΔH=-6 590 kJ·mol-1
下列说法正确的是( )
| A.2 mol C2H2(g)完全燃烧生成气态水时放热大于2 600 kJ |
| B.2 mol C6H6(l)完全燃烧生成液态水时放热大于6 590 kJ |
| C.相同条件下,等质量的C2H2(g)与C6H6(g)完全燃烧,C6H6(g)放热更多 |
| D.C2H2(g)三聚生成C6H6(g)的过程属于放热反应 |