题目内容
在某反应体系中,存在六种物质:Cr3+、 、
、 、H+、H2O和
、H+、H2O和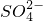 .已知:该反应中氧化反应只有Cr3+→Cr2O
.已知:该反应中氧化反应只有Cr3+→Cr2O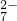 该反应过程中需要Ag+作催化剂,并加热.
该反应过程中需要Ag+作催化剂,并加热.
(1)写出该反应体系中发生反应的离子方程式:______.
(2)已知 中存在一个过氧键(-O-O-),则
中存在一个过氧键(-O-O-),则 中硫元素的化合价为______.
中硫元素的化合价为______.
(3)催化剂往往参加反应,改变反应途径.用离子方程式表示Ag+的催化过程:______.
(4)若将上述反应设计成一个原电池,用石墨作电极,则负极反应式为______,正极反应式为______.
解:(1)题目给出的六种物质,已知Cr3+→Cr2O72-发生氧化反应,一定有物质发生还原反应,S2O82-中存在一个过氧键(-O-O-),其中有2个氧原子为-1价,硫元素为+6价.SO42-中硫元素为+6价,故氧元素化合价降低,S2O82-为氧化剂,根据电子转移守恒:2Cr3++3S2O82-→Cr2O72-+6SO42-,由电荷守恒可知H+是生成物,由电荷守恒可知H2O是反应物,配平后离子方程式为:2Cr3++3S2O82-+7H2O=Cr2O72-+6SO42-+14H+,
故答案为:2Cr3++3S2O82-+7H2O=Cr2O72-+6SO42-+14H+;
(2)S2O82-中存在一个过氧键(-O-O-),其中有2个氧原子为-1价,令S元素化合价为a,根据化合价代数和等于所带电荷,则:2a+6×(-2)+2×(-1)=-2,解得a=6,故S2O82-中硫元素化合价为+6,
故答案为:+6;
(3)Ag+是强氧化剂,能把Cr3+氧化为Cr2O72-,Ag+本身被还原为Ag,S2O82-将Ag氧化为Ag+,Ag+的催化过程的离子方程式为:6Ag++2Cr3++7H2O=Cr2O72-+6Ag↓+14H+、S2O82-+2Ag=2Ag++2SO42-,
故答案为:6Ag++2Cr3++7H2O=Cr2O72-+6Ag↓+14H+、S2O82-+2Ag=2Ag++2SO42-;
(4)负极发生氧化反应,正极发生还原反应,结合2Cr3++3S2O82-+7H2O=Cr2O72-+6SO42-+14H+可知,负极电极反应式为:2Cr3++7H2O-6e-=Cr2O72-+14H+,正极电极反应式为:3S2O82-+6e-=6SO42-,
故答案为:2Cr3++7H2O-6e-=Cr2O72-+14H+;3S2O82-+6e-=6SO42-.
分析:(1)题目给出的六种物质,已知Cr3+→Cr2O72-发生氧化反应,一定有物质发生还原反应,S2O82-中存在一个过氧键(-O-O-),其中有2个氧原子为-1价,硫元素为+6价.SO42-中硫元素为+6价,故氧元素化合价降低,S2O82-为氧化剂,根据原子守恒、电荷守恒、电子转移守恒判断H+、H2O是反应物还是生成物,配平书写;
(2)S2O82-中存在一个过氧键(-O-O-),其中有2个氧原子为-1价,根据化合价代数和等于所带电荷计算S2O82-中硫元素;
(3)Ag+是强氧化剂,能把Cr3+氧化为Cr2O72-,Ag+本身被还原为Ag,S2O82-将Ag氧化为Ag+;
(4)负极发生氧化反应,正极发生还原反应,结合(1)中的方程式书写.
点评:本题考查氧化还原反应、化合价计算、常用化学用语、原电池原理等,题目难度较大,判断S2O82-中元素的化合价及书写离子方程式是关键.
故答案为:2Cr3++3S2O82-+7H2O=Cr2O72-+6SO42-+14H+;
(2)S2O82-中存在一个过氧键(-O-O-),其中有2个氧原子为-1价,令S元素化合价为a,根据化合价代数和等于所带电荷,则:2a+6×(-2)+2×(-1)=-2,解得a=6,故S2O82-中硫元素化合价为+6,
故答案为:+6;
(3)Ag+是强氧化剂,能把Cr3+氧化为Cr2O72-,Ag+本身被还原为Ag,S2O82-将Ag氧化为Ag+,Ag+的催化过程的离子方程式为:6Ag++2Cr3++7H2O=Cr2O72-+6Ag↓+14H+、S2O82-+2Ag=2Ag++2SO42-,
故答案为:6Ag++2Cr3++7H2O=Cr2O72-+6Ag↓+14H+、S2O82-+2Ag=2Ag++2SO42-;
(4)负极发生氧化反应,正极发生还原反应,结合2Cr3++3S2O82-+7H2O=Cr2O72-+6SO42-+14H+可知,负极电极反应式为:2Cr3++7H2O-6e-=Cr2O72-+14H+,正极电极反应式为:3S2O82-+6e-=6SO42-,
故答案为:2Cr3++7H2O-6e-=Cr2O72-+14H+;3S2O82-+6e-=6SO42-.
分析:(1)题目给出的六种物质,已知Cr3+→Cr2O72-发生氧化反应,一定有物质发生还原反应,S2O82-中存在一个过氧键(-O-O-),其中有2个氧原子为-1价,硫元素为+6价.SO42-中硫元素为+6价,故氧元素化合价降低,S2O82-为氧化剂,根据原子守恒、电荷守恒、电子转移守恒判断H+、H2O是反应物还是生成物,配平书写;
(2)S2O82-中存在一个过氧键(-O-O-),其中有2个氧原子为-1价,根据化合价代数和等于所带电荷计算S2O82-中硫元素;
(3)Ag+是强氧化剂,能把Cr3+氧化为Cr2O72-,Ag+本身被还原为Ag,S2O82-将Ag氧化为Ag+;
(4)负极发生氧化反应,正极发生还原反应,结合(1)中的方程式书写.
点评:本题考查氧化还原反应、化合价计算、常用化学用语、原电池原理等,题目难度较大,判断S2O82-中元素的化合价及书写离子方程式是关键.

练习册系列答案
 英才计划期末调研系列答案
英才计划期末调研系列答案 精英口算卡系列答案
精英口算卡系列答案
相关题目