题目内容
在某反应体系中存在六种物质:Cr3+、S2O82-、Cr2O72-、H+、H2O和SO42-.已知在该反应中氧化反应只有Cr3+→Cr2O72-,反应过程中需要Ag+作催化剂,并加热.请回答下列问题:
(1)已知S2O82-离子中存在一个过氧键(-O-O-),则S2O82-离子中硫元素的化合价为
(2)写出该反应体系中发生反应的离子方程式:
(3)催化剂往往参加反应,改变反应途径.用两个离子方程式表示Ag+的催化过程:
(1)已知S2O82-离子中存在一个过氧键(-O-O-),则S2O82-离子中硫元素的化合价为
+6
+6
价.(2)写出该反应体系中发生反应的离子方程式:
2Cr3++3S2O82-+7H2O
Cr2O72-+6SO42-+14H+
| ||
| △ |
2Cr3++3S2O82-+7H2O
Cr2O72-+6SO42-+14H+
.
| ||
| △ |
(3)催化剂往往参加反应,改变反应途径.用两个离子方程式表示Ag+的催化过程:
2Cr3++6Ag++7H2O=Cr2O72-+6Ag↓+14H+
2Cr3++6Ag++7H2O=Cr2O72-+6Ag↓+14H+
;2Ag+S2O82-=2Ag++2SO42-
2Ag+S2O82-=2Ag++2SO42-
.分析:(1)、S2O82-中存在一个过氧键(-O-O-),其中有2个氧原子为-1价,根据化合价代数和等于所带电荷计算S2O82-中硫元素;
(2)、题目给出的六种物质,已知Cr3+→Cr2O72-发生氧化反应,一定有物质发生还原反应,S2O82-中存在一个过氧键(-O-O-),其中有2个氧原子为-1价,硫元素为+6价.SO42-中硫元素为+6价,故氧元素化合价降低,S2O82-为氧化剂,根据原子守恒、电荷守恒、电子转移守恒判断H+、H2O是反应物还是生成物,配平书写;
(3)、Ag+是强氧化剂,能把Cr3+氧化为Cr2O72-,Ag+本身被还原为Ag,S2O82-将Ag氧化为Ag+.
(2)、题目给出的六种物质,已知Cr3+→Cr2O72-发生氧化反应,一定有物质发生还原反应,S2O82-中存在一个过氧键(-O-O-),其中有2个氧原子为-1价,硫元素为+6价.SO42-中硫元素为+6价,故氧元素化合价降低,S2O82-为氧化剂,根据原子守恒、电荷守恒、电子转移守恒判断H+、H2O是反应物还是生成物,配平书写;
(3)、Ag+是强氧化剂,能把Cr3+氧化为Cr2O72-,Ag+本身被还原为Ag,S2O82-将Ag氧化为Ag+.
解答:解:(1)、S2O82-中存在一个过氧键(-O-O-),其中有2个氧原子为-1价,令S元素化合价为a,根据化合价代数和等于所带电荷,则:2a+6×(-2)+2×(-1)=-2,解得a=6,故S2O82-中硫元素化合价为+6,
故答案为:+6;
(2)、题目给出的六种物质,已知Cr3+→Cr2O72-发生氧化反应,一定有物质发生还原反应,S2O82-中存在一个过氧键(-O-O-),其中有2个氧原子为-1价,硫元素为+6价.SO42-中硫元素为+6价,故氧元素化合价降低,S2O82-为氧化剂,根据电子转移守恒:2Cr3++3S2O82-→Cr2O72-+6SO42-,由电荷守恒可知H+是生成物,由电荷守恒可知H2O是反应物,配平后离子方程式为:2Cr3++3S2O82-+7H2O=Cr2O72-+6SO42-+14H+,
故答案为:2Cr3++3S2O82-+7H2O=Cr2O72-+6SO42-+14H+;
(3)Ag+是强氧化剂,能把Cr3+氧化为Cr2O72-,Ag+本身被还原为Ag,S2O82-将Ag氧化为Ag+,Ag+的催化过程的离子方程式为:6Ag++2Cr3++7H2O=Cr2O72-+6Ag↓+14H+、S2O82-+2Ag=2Ag++2SO42-,
故答案为:6Ag++2Cr3++7H2O=Cr2O72-+6Ag↓+14H+;S2O82-+2Ag=2Ag++2SO42-.
故答案为:+6;
(2)、题目给出的六种物质,已知Cr3+→Cr2O72-发生氧化反应,一定有物质发生还原反应,S2O82-中存在一个过氧键(-O-O-),其中有2个氧原子为-1价,硫元素为+6价.SO42-中硫元素为+6价,故氧元素化合价降低,S2O82-为氧化剂,根据电子转移守恒:2Cr3++3S2O82-→Cr2O72-+6SO42-,由电荷守恒可知H+是生成物,由电荷守恒可知H2O是反应物,配平后离子方程式为:2Cr3++3S2O82-+7H2O=Cr2O72-+6SO42-+14H+,
故答案为:2Cr3++3S2O82-+7H2O=Cr2O72-+6SO42-+14H+;
(3)Ag+是强氧化剂,能把Cr3+氧化为Cr2O72-,Ag+本身被还原为Ag,S2O82-将Ag氧化为Ag+,Ag+的催化过程的离子方程式为:6Ag++2Cr3++7H2O=Cr2O72-+6Ag↓+14H+、S2O82-+2Ag=2Ag++2SO42-,
故答案为:6Ag++2Cr3++7H2O=Cr2O72-+6Ag↓+14H+;S2O82-+2Ag=2Ag++2SO42-.
点评:本题考查了氧化还原反应配平、化合价计算、常用化学用语,题目难度较大,判断S2O82-中元素的化合价及书写离子方程式是关键.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
 、
、 、H+、H2O和
、H+、H2O和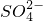 .已知:该反应中氧化反应只有Cr3+→Cr2O
.已知:该反应中氧化反应只有Cr3+→Cr2O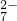 该反应过程中需要Ag+作催化剂,并加热.
该反应过程中需要Ag+作催化剂,并加热.