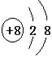
题目内容
a、b、c、d是四种短周期元素。a、b、d同周期,c、d同主族。a的原子结构示意图为 ,b与c形成化合物的电子式为
,b与c形成化合物的电子式为 。下列比较中正确的是
。下列比较中正确的是
 ,b与c形成化合物的电子式为
,b与c形成化合物的电子式为 。下列比较中正确的是
。下列比较中正确的是| A.原子半径:a>c>d>b | B.电负性a>b>d>c |
| C.原子序数:a>d>b>c | D.最高价含氧酸的酸性c>d>a |
D
由于a原子核外有三层电子,故为第三周期元素,只有x=2符合题意,即它为硅元素;进而可知,b、d均为第三周期元素,而b与c形成化合物的电子式为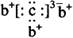 可推知b、c分别呈现+1、-3价,则b为钠元素,c为氮元素;d为磷元素。
可推知b、c分别呈现+1、-3价,则b为钠元素,c为氮元素;d为磷元素。
则依据元素周期律可知:
原子半径:b>a>d>c;电负性:c>d>a>b;
原子序数:d>a>b>c;最高价含氧酸的酸性c>d>a
故答案为D
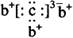 可推知b、c分别呈现+1、-3价,则b为钠元素,c为氮元素;d为磷元素。
可推知b、c分别呈现+1、-3价,则b为钠元素,c为氮元素;d为磷元素。则依据元素周期律可知:
原子半径:b>a>d>c;电负性:c>d>a>b;
原子序数:d>a>b>c;最高价含氧酸的酸性c>d>a
故答案为D

练习册系列答案
 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案
相关题目

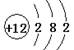 ,
,