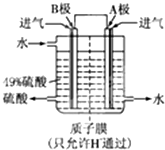
题目内容
 (2012?长春三模)A、B、C、D都是中学化学中常见物质,其中A、B、C均含有同一种元素,在一定条件下相互转化关系如图(部分反应中的水已略去).
(2012?长春三模)A、B、C、D都是中学化学中常见物质,其中A、B、C均含有同一种元素,在一定条件下相互转化关系如图(部分反应中的水已略去).(1)若A为氯碱工业的产品,C为厨房中的用品.
①反应Ⅲ的离子方程式是
HCO3-+OH-═CO32-+H2O
HCO3-+OH-═CO32-+H2O
.②同浓度的B与C溶液的pH
Na2CO3
Na2CO3
>NaHCO3
NaHCO3
(用化学式表示),原因是水解呈碱性,且Na2CO3水解程度大于NaHCO3
水解呈碱性,且Na2CO3水解程度大于NaHCO3
.③B溶液中除H+外其它离子浓度的大小关系为
c(Na+ )>c(CO32-)>c(OH-)>c(HCO3-)
c(Na+ )>c(CO32-)>c(OH-)>c(HCO3-)
.(2)若A、D均为单质,且A为气体,D元素的一种红棕色氧化物常用作颜料.
①反应Ⅱ的离子方程式是
Fe+2Fe2+═3Fe3+
Fe+2Fe2+═3Fe3+
.②B可作净水剂,其原因是
Fe3++3H2O?Fe(OH)3+3H+
Fe3++3H2O?Fe(OH)3+3H+
(用离子方程式表示).D的一种钠盐为Na2DO4不仅可以对水进行杀菌消毒,且消毒后还有净化水的功效,请说明原因Na2FeO4利用其氧化性进行杀菌消毒,从而生成三价铁离子,水解生成氢氧化铁胶体从而达到净水作用
Na2FeO4利用其氧化性进行杀菌消毒,从而生成三价铁离子,水解生成氢氧化铁胶体从而达到净水作用
.分析:(1)若A为氯碱工业的产品,C为厨房中的用品,可知A为NaOH,C为NaHCO3,B为Na2CO3,D为CO2,Na2CO3,NaHCO3是弱酸强碱盐,是在水的作用下而发生水解显碱性;
(2)D元素的一种红棕色氧化物常用作颜料,应为氧化铁,则D为Fe,A为Cl2,B为FeCl3,C为FeCl2.
(2)D元素的一种红棕色氧化物常用作颜料,应为氧化铁,则D为Fe,A为Cl2,B为FeCl3,C为FeCl2.
解答:解:(1)若A为氯碱工业的产品,C为厨房中的用品,可知A为NaOH,C为NaHCO3,B为Na2CO3,D为CO2,Na2CO3,NaHCO3是弱酸强碱盐,是在水的作用下而发生水解显碱性,
①反应Ⅲ为NaOH和NaHCO3的反应,反应的离子方程式是HCO3-+OH-=CO32-+H2O,
故答案为:HCO3-+OH-═CO32-+H2O;
②Na2CO3、NaHCO3是弱酸强碱盐,水解呈碱性,且Na2CO3水解程度大于NaHCO3,
故答案为:Na2CO3;NaHCO3;水解呈碱性,且Na2CO3水解程度大于NaHCO3;
③B为Na2CO3,CO32-离子水解生成HCO3-离子,HCO3-离子进一步水解生成碳酸,则有c(Na+ )>c(CO32-)>c(OH-)>c(HCO3-),
故答案为:c(Na+ )>c(CO32-)>c(OH-)>c(HCO3-);
(2)D元素的一种红棕色氧化物常用作颜料,应为氧化铁,则D为Fe,A为Cl2,B为FeCl3,C为FeCl2,
①反应Ⅱ的离子方程式是Fe+2Fe2+═3Fe3+,
故答案为:Fe+2Fe2+═3Fe3+;
②B为FeCl3,可水解生成具有吸附性的Fe(OH)3,可用于净水,水解方程式为Fe3++3H2O?Fe(OH)3+3H+,Na2FeO4不仅可以对水进行杀菌消毒,且消毒后还有净化水的功效,原因是利用其氧化性进行杀菌消毒,从而生成三价铁离子,水解生成氢氧化铁胶体从而达到净水作用.
故答案为:Fe3++3H2O?Fe(OH)3+3H+;Na2FeO4利用其氧化性进行杀菌消毒,从而生成三价铁离子,水解生成氢氧化铁胶体从而达到净水作用.
①反应Ⅲ为NaOH和NaHCO3的反应,反应的离子方程式是HCO3-+OH-=CO32-+H2O,
故答案为:HCO3-+OH-═CO32-+H2O;
②Na2CO3、NaHCO3是弱酸强碱盐,水解呈碱性,且Na2CO3水解程度大于NaHCO3,
故答案为:Na2CO3;NaHCO3;水解呈碱性,且Na2CO3水解程度大于NaHCO3;
③B为Na2CO3,CO32-离子水解生成HCO3-离子,HCO3-离子进一步水解生成碳酸,则有c(Na+ )>c(CO32-)>c(OH-)>c(HCO3-),
故答案为:c(Na+ )>c(CO32-)>c(OH-)>c(HCO3-);
(2)D元素的一种红棕色氧化物常用作颜料,应为氧化铁,则D为Fe,A为Cl2,B为FeCl3,C为FeCl2,
①反应Ⅱ的离子方程式是Fe+2Fe2+═3Fe3+,
故答案为:Fe+2Fe2+═3Fe3+;
②B为FeCl3,可水解生成具有吸附性的Fe(OH)3,可用于净水,水解方程式为Fe3++3H2O?Fe(OH)3+3H+,Na2FeO4不仅可以对水进行杀菌消毒,且消毒后还有净化水的功效,原因是利用其氧化性进行杀菌消毒,从而生成三价铁离子,水解生成氢氧化铁胶体从而达到净水作用.
故答案为:Fe3++3H2O?Fe(OH)3+3H+;Na2FeO4利用其氧化性进行杀菌消毒,从而生成三价铁离子,水解生成氢氧化铁胶体从而达到净水作用.
点评:本题是以常见的化学物质为载体,考查了元素化合物质之间的转化及他们涉及的化学反应原是的相关知识,为高考常见题型,侧重于学生的分析能力、推断能力和综合运用元素化合物知识,注意把握题给信息,找出推断的突破口,把握相关物质的性质以及离子方程式、化学方程式的书写,难度中等.

练习册系列答案
相关题目