题目内容
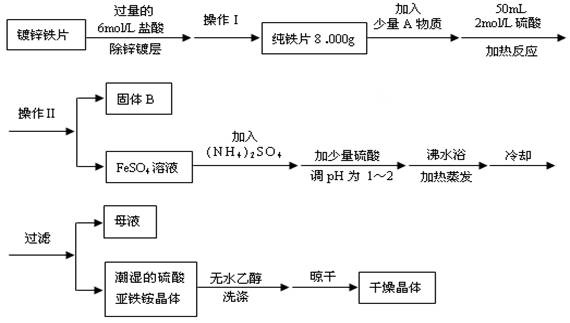
硫酸亚铁铵(NH4)2Fe(SO4)2·6H2O是一种浅绿色晶体,在水中的溶解度较小,不溶于乙醇。某实验小组利用镀锌铁片来制备硫酸亚铁铵的过程如下:

(1)加入盐酸是为了除去锌镀层,判断锌镀层已被除去的现象是 。
(2)A物质可以是 (选填序号)。
a.CuCl2 b.CuO c.Cu(NO3)2 d.CuSO4
加入少量A物质的目的是 。
(3)操作Ⅱ的名称为 。
(4)采用晾干而不用加热烘干晶体的原因是 。
(5)工业上常用K2Cr2O7溶液测定硫酸亚铁铵的纯度,反应中Cr2O72—被还原成Cr3+。
写出硫酸亚铁铵溶液与酸性K2Cr2O7溶液反应的离子方程式 。
16.(12分)
(1)反应速率突然减小(或铁片表面生成的气泡突然减少,意思相近均给分)(2分)
(2)b、d(2分,答对1个给1分,答对2个给2分,见错不给分)
加快铁与稀硫酸的反应速率(2分)
(3)过滤(2分)
(4)避免加热过程中晶体受热分解失去结晶水或被空气氧化(2分)
(5)6Fe2++Cr2O72—+14H+=2Cr3++6Fe3++7H2O(2分)
【解析】
试题分析:
(1)镀锌铁片放入盐酸中可以形成Zn-HCl-Fe原电池,并且能加快H+的反应速率,具体现象是气泡突然减少。
(2)加入的A物质主要是为后续反应加快速率,通过构成Fe-H2SO4-Cu原电池来实现,最终溶液中要生成FeSO4,所以a.CuCl2 不能选,最终会有FeCl2杂质,c.Cu(NO3)2 会带来NO3-离子,将会产生有毒气氮氧化物且会带来杂质Cu(NO3)2,只有b.CuO 和d.CuSO4不会带来杂质且能加快反应速率。
(3)操作Ⅱ的名称为过滤,除去未反应完的铁和铜。
(4)由于目标物中(NH4)2Fe(SO4)2·6H2O中的即有结晶水,同时铁为+2 价,若采用加热烘干可能会失去结晶水和加快+2 价的氧化。
(5)根据氧化还原规律,一个反应中有元素化合升高,必然有降低的,题目已经告诉了Cr2O72—被还原成Cr3+元素化合价是降低的,硫酸亚铁铵溶液中只有Fe2+化合价升高到+3价,先根据得失电子相等写出6Fe2++Cr2O72—=2Cr3++6Fe3+,再根据溶液的性质通过电荷守恒完成方程式缺项配平,左边加H+,在边加H2O;
考点:本题以工艺流程为基础,考元素及化合物、化学实验基本操作、原电池原理和氧化还原方程式配平等相关知识。

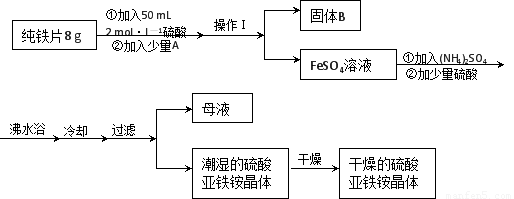
 8分)亚铁盐在空气中易被氧化,但形成复盐可稳定存在。硫酸亚铁铵[(NH4)2SO4?FeSO4?6H2O]是一种重要化学试剂,实验室可用纯铁片来制
8分)亚铁盐在空气中易被氧化,但形成复盐可稳定存在。硫酸亚铁铵[(NH4)2SO4?FeSO4?6H2O]是一种重要化学试剂,实验室可用纯铁片来制 取硫酸亚铁铵,流程如下:
取硫酸亚铁铵,流程如下:
 ,所用主要仪器和用品有(铁架台、铁圈除外)
,所用主要仪器和用品有(铁架台、铁圈除外)