题目内容
3.第116号元素Lv的名称为鉝.关于${\;}_{116}^{293}$Lv的叙述正确的是( )| A. | 该元素与氧元素属于同族 | B. | 中子数为116 | ||
| C. | 质子数为177 | D. | 该元素的相对原子质量是293 |
分析 根据在原子中:原子序数=质子数=核外电子数=核电荷数,进行解答.
解答 解:A.第116号元素Lv的原子序数为116,位于第七周期,第ⅥA族,所以与氧元素属于同族,故A正确;
B.中子数=质量数-质子数=293-116=177,故B错误;
C.原子序数=质子数=核外电子数=核电荷数,可知质子数为116,故C错误;
D.293代表该原子的质量数,一种元素有多种核素,质量数指的是质子与中子质量的和,不同核素的质量数不同,即一种元素可以有多个质量数,相对原子质量为各核素的平均相对质量,所以同种元素的相对原子质量只有一个数值,两者近似相等,故D错误.
故选A.
点评 本题主要考查了原子符号的含义,掌握原子序数=核内质子数=核电荷数是解题的关键,题目难度不大.

练习册系列答案
 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案
相关题目
14.某矿物X由Al2O3、Fe2O3、Cu2O、SiO2中的一种或几种物质组成.现进行如图所示实验:
(已知:Cu2O+2H+═Cu+Cu2++H2O)( )

(已知:Cu2O+2H+═Cu+Cu2++H2O)( )
| A. | 步骤1中减少的固体一定是混合物 | |
| B. | 根据上述步骤可以判断矿物X中$\frac{n(F{e}_{2}{O}_{3})}{n(C{u}_{2}O)}$<1 | |
| C. | 根据步骤2可以得出蓝色溶液中n(Cu2+)=0.02mol | |
| D. | 根据步骤1、2可以判断出X中氧化铁的质量分数为50% |
11.下列反应中,划线元素被还原的是( )
| A. | 2H2S+SO2═3S↓+2H2O | B. | Zn+CuSO4═Cu+ZnSO4 | ||
| C. | KClO3+6HCl═KCl+3Cl2↑+H2O | D. | 2FeCl2+Cl2═2FeCl3 |
18.只用一种试剂即可鉴别氯化镁、氯化铁、氯化亚铁、氯化铵、氯化钠这五种溶液,该试剂是( )
| A. | KSCN | B. | BaCl2 | C. | HCl | D. | NaOH |
15.以下实验能获得成功的是( )
| A. | 将铁屑、溴水、苯混合制溴苯 | |
| B. | 可用甲烷与氯气光照的方法制取纯净的一氯甲烷 | |
| C. | 用紫色石蕊试液检验苯酚溶液的弱酸性 | |
| D. | 可以用苯、浓硝酸和浓硫酸水浴加热制硝基苯 |
12.下表是元素周期表的一部分,针对表中所列①~⑩元素,填写下列空白.
(1)单质性质最不活泼的元素的原子结构示意图是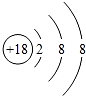 .
.
(2)地壳中含量最多的元素在元素周期表中的位置为第二周期ⅥA族.
(3)元素①的气态氢化物的化学式为CH4,其中含有的化学键的类型为极性键.
(4)第三周期元素的最高价氧化物对应水化物中,酸性最强的是HClO4(填化学式,下同),具有两性的是Al(OH)3.
(5)元素⑦的氧化物与氢氧化钠溶液反应的产物是NaAlO2和H2O.
(6)用电子式表示元素⑤与④的化合物的形成过程: .
.
| 周期 族 | IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ① | ② | ③ | ④ | ||||
| 三 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
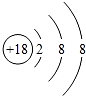 .
.(2)地壳中含量最多的元素在元素周期表中的位置为第二周期ⅥA族.
(3)元素①的气态氢化物的化学式为CH4,其中含有的化学键的类型为极性键.
(4)第三周期元素的最高价氧化物对应水化物中,酸性最强的是HClO4(填化学式,下同),具有两性的是Al(OH)3.
(5)元素⑦的氧化物与氢氧化钠溶液反应的产物是NaAlO2和H2O.
(6)用电子式表示元素⑤与④的化合物的形成过程:
 .
.
13.下列实验设计不能达到实验目的是( )
| A. | 用燃着的木条区分氧气和二氧化碳 | |
| B. | 用盐酸除去石灰水中的少量CaCO3 | |
| C. | 用盐酸除去铁钉表面的少量铁锈 | |
| D. | 用盐酸验证敞口放置的NaOH溶液已变质 |
