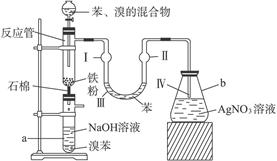
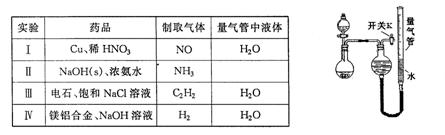
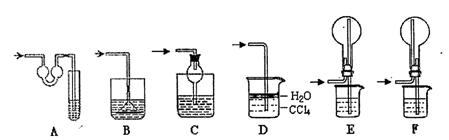
题目内容
(12分)某化学兴趣小组为了探索铝电极在原电池中的作用,设计并进行了以下一系列实验,实验结果记录如下:
试根据上表中的实验现象回答下列问题:
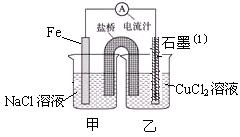
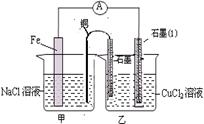
(1)实验1、2中Al所作的电极是否相同?____________。
(2)写出实验3中的电极反应式。
铝为( )______________;石墨为( )_____________;
(3)实验4中的铝作正极还是负极?写出电池总反应方程式。
(4)解释实验5中电流指针偏向铝的原因。
(5)根据实验结果总结:在原电池中金属铝作正极还是作负极受哪些因素的影响?
| 编号 | 电极材料 | 电解质溶液 | 电流指针偏转方向 |
| 1 | Mg Al | 稀盐酸 | 偏向Al |
| 2 | Al Cu | 稀盐酸 | 偏向Cu |
| 3 | Al 石墨 | 稀盐酸 | 偏向石墨 |
| 4 | Mg Al | NaOH溶液 | 偏向Mg |
| 5 | Al Zn | 浓硝酸 | 偏向Al |
(1)实验1、2中Al所作的电极是否相同?____________。
(2)写出实验3中的电极反应式。
铝为( )______________;石墨为( )_____________;
(3)实验4中的铝作正极还是负极?写出电池总反应方程式。
(4)解释实验5中电流指针偏向铝的原因。
(5)根据实验结果总结:在原电池中金属铝作正极还是作负极受哪些因素的影响?
(12分)(1)不同(1分)
(2)负极:2Al-6e- → 2Al3+(2分);正极:6H+ + 6e- → 3H2↑(2分)
(3)负极(1分);电池总反应式:2Al +2NaOH+6H2O = 2Na[Al(OH)4]+ 3H2↑(2分)
(4)由于铝在浓硝酸中发生钝化,反以锌为负极。(2分)
(5)与另一种材料的活泼性、电解质溶液的酸碱性以及电解质溶液的氧化性强弱等因素有关。(2分)
(2)负极:2Al-6e- → 2Al3+(2分);正极:6H+ + 6e- → 3H2↑(2分)
(3)负极(1分);电池总反应式:2Al +2NaOH+6H2O = 2Na[Al(OH)4]+ 3H2↑(2分)
(4)由于铝在浓硝酸中发生钝化,反以锌为负极。(2分)
(5)与另一种材料的活泼性、电解质溶液的酸碱性以及电解质溶液的氧化性强弱等因素有关。(2分)
略

练习册系列答案
 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案
相关题目
 .0mL
.0mL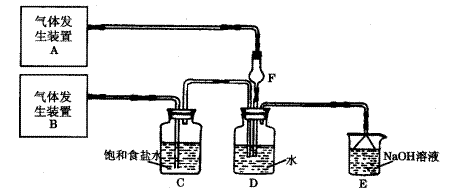
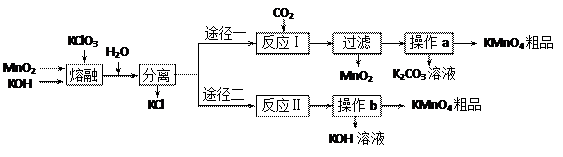 已知:①3MnO2+KClO3+6KOH
已知:①3MnO2+KClO3+6KOH 3K2MnO4+KCl+3H2O
3K2MnO4+KCl+3H2O ⑵反应Ⅰ中氧化产物与还原产物的物质的量之比为 ▲ ;该反应中可以循环利用的产物是 ▲ 。
⑵反应Ⅰ中氧化产物与还原产物的物质的量之比为 ▲ ;该反应中可以循环利用的产物是 ▲ 。